题目内容
【题目】I.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)现有一瓶放置了一段时间的某浓度的FeCl3溶液,请设计实验检验其中是否含有Fe3+_____。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2(已换算到标况下),则转移电子数目为_______;“引火铁” 是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
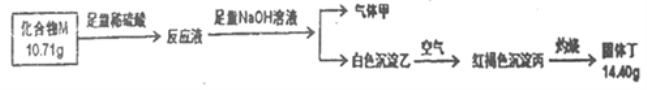
气体甲可使湿润红色石蕊试纸交蓝。请回答:
(1)M的化学式___________,气体甲的电子式__________。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)_______________。(3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________。
【答案】 氧化 取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有 4NA 引火铁表而积很大,加快了与氧气反应速度 Fe4N ![]() 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2O3+2NH3
4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2O3+2NH3![]() 2Fe+N2+3H2O
2Fe+N2+3H2O
【解析】I.(1)NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力,原因是氧化了血红蛋白中的二价铁,药品美蓝是其有效的解毒剂,这说明该物质具有还原性,因此解毒时美蓝发生氧化反应;正确答案:氧化。
(2)一般用硫氰化钾溶液检验铁离子,操作过程:取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有;正确答案:取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有。
(3)标况下44.8LH2,其物质的量为2mol,反应转移的电子数目为2×2×NA=4NA;引火铁表而积很大,加快了与氧气反应速度,因此在空气中可以自燃;正确答案:4NA ;引火铁表而积很大,加快了与氧气反应速度。
II.气体甲可使湿润红色石蕊试纸交蓝,气体甲为氨气,说明化合物M中含有氮元素;白的沉淀乙→红褐色沉淀丙,说明化合物M中含有铁元素;红褐色沉淀丙→固体丁(14.4g),固体丁为氧化铁,根据元素守恒计算化学式。
(1)根据以上分析可知,M由铁、氮两种元素组成,氧化铁质量为14.4g,则铁元素的质量为14.4×112/160=10.08g,氮元素质量为10.71-10.08=0.63 g,铁、氮两种元素的量之比为10.08/56:0.63/14=4:1,所以M的化学式Fe4N;氮气为共价化合物,氮氢间为单键,氨气的电子式为![]() ;正确答案:Fe4N;
;正确答案:Fe4N;![]() 。
。
(2)白色沉淀乙是氢氧化亚铁,在空气中被氧气氧化为红褐色氢氧化铁,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;正确答案:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)高温条件下,氧化铁与氨气反应生成铁、氮气和水,该反应的化学方程式为:Fe2O3+2NH3![]() 2Fe+N2+3H2O;正确答案:Fe2O3+2NH3
2Fe+N2+3H2O;正确答案:Fe2O3+2NH3![]() 2Fe+N2+3H2O。
2Fe+N2+3H2O。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D