题目内容
T ℃时,有甲、乙两个密闭容器,甲容器的体积为![]()
A.甲容器中反应的平均速率![]() (B)=0.3 mol/(L·min)
(B)=0.3 mol/(L·min)
B.化学方程式中计量数b=1
C.乙容器中反应达到平衡时所需时间大于4 min
D.T ℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入3 mol C和2 mol D
D
解析:甲容器中发生的反应为:
![]()
起(mol·L-1): 6 3 0 0
变(mol·L-1): 3.6 1.2
平(mol·L-1): 2.4 1.8
![]() (B)=
(B)=![]() =0.3 mol·(L·min)-1,A结论正确。又
=0.3 mol·(L·min)-1,A结论正确。又![]() ,b=1,B结论正确。相对于甲容器,乙容器中A、B开始时的浓度小,达到平衡所用时间多,C结论正确。利用“一边倒法”,可知“3 mol C和2 mol D”与“6 mol A和3 mol B”不能恰好反应转化,两组物料在相同外界条件下不能建立起相同的化学平衡状态,D结论错误。
,b=1,B结论正确。相对于甲容器,乙容器中A、B开始时的浓度小,达到平衡所用时间多,C结论正确。利用“一边倒法”,可知“3 mol C和2 mol D”与“6 mol A和3 mol B”不能恰好反应转化,两组物料在相同外界条件下不能建立起相同的化学平衡状态,D结论错误。

练习册系列答案
相关题目
 3C(g)+2D(g),
3C(g)+2D(g),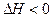 ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题: 3C(g)+2D(g),
3C(g)+2D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题: