题目内容
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:
3A(g)+b B(g)?3C(g)+2D(g),(b为≤3的正整数).
4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;
t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L.
根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率
(B)=
(2)在温度T℃时,该反应的化学平衡常数为
由下表数据可知该反应为
化学平衡常数K和温度t的关系如下表:
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是
3A(g)+b B(g)?3C(g)+2D(g),(b为≤3的正整数).
4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;
t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L.
根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率
. |
| v |
0.3mol/(L?min)
0.3mol/(L?min)
.(2)在温度T℃时,该反应的化学平衡常数为
10.8
10.8
.由下表数据可知该反应为
吸热
吸热
(填“吸热”“放热”)反应.化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
3mol
3mol
、2mol
2mol
.分析:(1)根据v=
计算v(B);
(2)根据甲容器计算,根据A、B的浓度变化量计算b的值,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
由表中数据可知,温度越高,平衡常数越大,说明升高温度平衡向正反应方向移动,据此判断;
(3)丙与乙为完全等效平衡,按化学计量数转化到左边,满足n(A)=6mol、n(B)=3mol,据此计算.
| △c |
| △t |
(2)根据甲容器计算,根据A、B的浓度变化量计算b的值,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
由表中数据可知,温度越高,平衡常数越大,说明升高温度平衡向正反应方向移动,据此判断;
(3)丙与乙为完全等效平衡,按化学计量数转化到左边,满足n(A)=6mol、n(B)=3mol,据此计算.
解答:解:(1)4min后甲容器内的反应达到平衡时B的浓度为1.8mol/L,B的起始浓度为3mol/L,故v(B)=
=0.3mol/(L?min),
故答案为:0.3mol/(L?min);
(2)达到平衡是,A的浓度为2.4mol/L,△c(A)=6mol/L-2.4mol/L=3.6mol/L.平衡时B的浓度为1.8mol/L,△c(B)=3mol/L-1.8mol/L=1.2mol/L,故3:b=3.6:1.2,解得b=1,则:
3A(g)+B(g)?3C(g)+2D(g),
开始(mol/L):6 3 0 0
变化(mol/L):3.6 1.2 3.6 2.4
平衡(mol/L):2.4 1.8 3.6 2.4
故该温度下平衡常数k=
=10.8,
由表中数据可知,温度越高,平衡常数越大,说明升高温度平衡向正反应方向移动,故正反应是吸热反应,
故答案为;10.8;吸热;
(3)丙容器中达到平衡时B的浓度仍然为0.8mol/L,丙与乙为完全等效平衡,按化学计量数转化到左边,满足n(A)=6mol、n(B)=3mol,丙容器中加入C、D的物质的量分别为3mol、2mol,转化到左边可以得到3molA、1molB,故还需加入A的物质的量为6mol-3mol=3mol、需要加入B的物质的量为3mol-1mol=2mol,
故答案为:3mol;2mol.
| 3mol/L-1.8mol/L |
| 4min |
故答案为:0.3mol/(L?min);
(2)达到平衡是,A的浓度为2.4mol/L,△c(A)=6mol/L-2.4mol/L=3.6mol/L.平衡时B的浓度为1.8mol/L,△c(B)=3mol/L-1.8mol/L=1.2mol/L,故3:b=3.6:1.2,解得b=1,则:
3A(g)+B(g)?3C(g)+2D(g),
开始(mol/L):6 3 0 0
变化(mol/L):3.6 1.2 3.6 2.4
平衡(mol/L):2.4 1.8 3.6 2.4
故该温度下平衡常数k=
| 3.63×2.42 |
| 2.43×1.8 |
由表中数据可知,温度越高,平衡常数越大,说明升高温度平衡向正反应方向移动,故正反应是吸热反应,
故答案为;10.8;吸热;
(3)丙容器中达到平衡时B的浓度仍然为0.8mol/L,丙与乙为完全等效平衡,按化学计量数转化到左边,满足n(A)=6mol、n(B)=3mol,丙容器中加入C、D的物质的量分别为3mol、2mol,转化到左边可以得到3molA、1molB,故还需加入A的物质的量为6mol-3mol=3mol、需要加入B的物质的量为3mol-1mol=2mol,
故答案为:3mol;2mol.
点评:本题考查化学反应速率计算、化学平衡常数、等效平衡等,难度中等,(3)中注意理解等效平衡规律.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
 3C(g)+2D(g),
3C(g)+2D(g),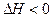 ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题: 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题: 3C(g)+2D(g),
3C(g)+2D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题: