题目内容
下列与平衡移动无关的是( )
| A.向0.1mol/L的CH3COOH中加入少量CH3COONa固体,溶液pH增大 |
| B.新制氯水放置一段时间后颜色消失 |
| C.在密闭容器中充入一定量NO2建立2NO2(g)?N2O4(g)平衡后,增大压强,体系颜色加深 |
| D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
A.醋酸为弱电解质,溶液中存在电离平衡,加入醋酸钠后溶液中醋酸根离子浓度增大,抑制了醋酸的电离,溶液中氢离子浓度减小,溶液的pH增大,该变化与平衡移动有关,故A错误;
B.氯水中存在氯气与水的反应平衡,反应生成的次氯酸容易分解,导致氯气与水的反应向着正向移动,最终氯气完全反应,溶液颜色消失,该变化与平衡移动有关,故B错误;
C.该反应是体积缩小的反应,增大压强,平衡向着正向移动,二氧化氮含量减小,但二氧化氮的浓度增大了,所以混合气体颜色加深,该变化与平衡移动无关,与二氧化氮的浓度有关,故C正确;
D.碳酸钠溶液中,碳酸根离子存在水解平衡,加入氯化钡后,溶液中碳酸根离子浓度减小,溶液中碳酸根水解生成的氢氧根离子浓度减小,当碳酸根离子完全转化成碳酸钡沉淀,溶液红色消失,该变化与平衡移动有关,故D错误;
故选C.
B.氯水中存在氯气与水的反应平衡,反应生成的次氯酸容易分解,导致氯气与水的反应向着正向移动,最终氯气完全反应,溶液颜色消失,该变化与平衡移动有关,故B错误;
C.该反应是体积缩小的反应,增大压强,平衡向着正向移动,二氧化氮含量减小,但二氧化氮的浓度增大了,所以混合气体颜色加深,该变化与平衡移动无关,与二氧化氮的浓度有关,故C正确;
D.碳酸钠溶液中,碳酸根离子存在水解平衡,加入氯化钡后,溶液中碳酸根离子浓度减小,溶液中碳酸根水解生成的氢氧根离子浓度减小,当碳酸根离子完全转化成碳酸钡沉淀,溶液红色消失,该变化与平衡移动有关,故D错误;
故选C.

练习册系列答案
相关题目
 ( )
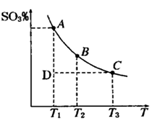
( ) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题: