题目内容
如图所示,向A和B中都充入2mol X和2molY,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
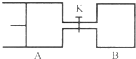
| A.两容器中达到平衡的时间A<B |
| B.A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C.打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D.打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |

A、起始时VA=0.8aL,VB=aL,A装置中的浓度大于B装置中的浓度,但随着反应的进行,最终VA=0.9aL,仍然A装置中的浓度大于B装置中的浓度,所以两容器中达到平衡的时间A<B,故A正确;
B、达到平衡时,VA=0.9aL,等压、等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是
×0.9=4.5mol,设参加反应的A的物质的量为mmol,则:
X(g)+Y(g)?2Z(g)+W(g)
起始(mol) 2 2 0 0
反应(mol) m m 2mm
平衡(mol) 2-m 2-m2m m
即2-m+2-m+2m+m=4.5mol,解得:m=0.5,所以X物质的转化率=
×100%=25%;
B装置是在恒容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,故B中X转化率小于A中X转化率,故B正确;
C、打开K达新平衡等效为A中到达的平衡,X的转化率为25%,参加反应的X的总的物质的量为4mol×25%=1mol,
X(g)+Y(g)?2Z(g)+W(g)
起始(mol)4 4 0 0
反应(mol)11 2 1
平衡(mol)3 321
故平衡后容器内总的物质的量为3mol+3mol+2mol+1mol=9mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为
×9mol=1.8aL,则VA=1.8aL-0.8aL,故C正确;
D、反应X(g)+Y(g)?2Z(g)+W(g)△H<0,所以升高温度,平衡向逆反应方向移动,但升高温度,气体膨胀,体积增大,所以则A容器的体积可能增大,也可能减小,故D错误.
故选D.
B、达到平衡时,VA=0.9aL,等压、等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是
| 4mol |
| 0.8 |
X(g)+Y(g)?2Z(g)+W(g)
起始(mol) 2 2 0 0
反应(mol) m m 2mm
平衡(mol) 2-m 2-m2m m
即2-m+2-m+2m+m=4.5mol,解得:m=0.5,所以X物质的转化率=
| 0.5mol |
| 2mol |
B装置是在恒容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,故B中X转化率小于A中X转化率,故B正确;
C、打开K达新平衡等效为A中到达的平衡,X的转化率为25%,参加反应的X的总的物质的量为4mol×25%=1mol,
X(g)+Y(g)?2Z(g)+W(g)
起始(mol)4 4 0 0
反应(mol)11 2 1
平衡(mol)3 321
故平衡后容器内总的物质的量为3mol+3mol+2mol+1mol=9mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为
| 0.8a |
| 4mol |
D、反应X(g)+Y(g)?2Z(g)+W(g)△H<0,所以升高温度,平衡向逆反应方向移动,但升高温度,气体膨胀,体积增大,所以则A容器的体积可能增大,也可能减小,故D错误.
故选D.

练习册系列答案
相关题目
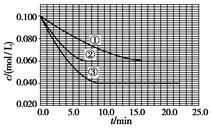
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)