题目内容
【题目】实验室为测定一新配的稀盐酸的准确浓度,通常用纯净的![]() (无水)配成溶液进行滴定。称取W克纯净无水
(无水)配成溶液进行滴定。称取W克纯净无水![]() 装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)由于![]() 溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
A.石蕊 B.甲基橙 C.酚酞
(2)滴定达到终点时溶液的颜色变化是________。写出上述滴定反应的离子方程式:_______。
(3)若达到滴定终点时,W克![]() 消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
(4)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“![]() ”反应中
”反应中![]() 和
和![]() 的相互转化。实验如下:
的相互转化。实验如下:
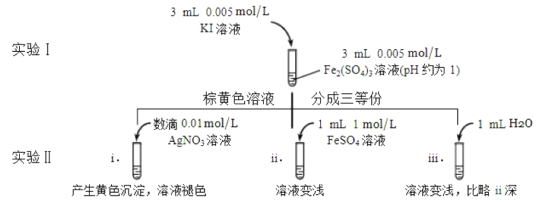
①待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到_______。
②iii是ii的对比实验,目的是排除有ii中______造成的影响。
③i和ii的颜色变化表明平衡___移动(填写“正向”或“逆向”或“不”)。用化学平衡移动原理解释原因:________。
【答案】B 由黄色变为橙色 ![]() 、
、![]()
![]() 化学平衡状态 溶液稀释,
化学平衡状态 溶液稀释,![]() 降低 逆向 i中
降低 逆向 i中![]() 消耗
消耗![]() :
:![]() ,
,![]() 浓度下降,使平衡
浓度下降,使平衡![]() 逆向移动;ii中增大
逆向移动;ii中增大![]() 浓度,同样平衡
浓度,同样平衡![]() 逆向移动
逆向移动
【解析】
(1)由于CO2 的溶解会影响溶液pH ,为准确滴定,终点宜选在溶液pH 为45 之间,
A.石蕊变色范围宽且颜色不易观察,不能用做中和滴定的指示剂,故A错误;
B.甲基橙变色范围是3.14.4 可以指示反应终点,故B正确;
C.酚酞指示剂变色范围810 ,产生的误差较大,故C错误;
答案选B;
(2)用盐酸滴定碳酸钠,以甲基橙做指示剂,终点颜色变化为溶液由黄色变化为橙色且半分钟不变化,滴定过程中发生的化学反应为![]() 、
、![]() ,
,
答案为:溶液由黄色变化为橙色;![]() 、
、![]() ;
;
(3)达到滴定终点时,Na2CO3 2HCl
1 2
![]() V×10 3 L×c
V×10 3 L×c
V×10 3 L×c =2×![]()
解得c=![]() mol/L ;
mol/L ;
故答案为:![]() 。
。
(4)①待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,否则干扰平衡移动的判断,
故答案为:化学平衡状态;
②由实验iii和实验ii的对比可知,对比实验的目的是为了排除有ii中水造成溶液中离子浓度改变的影响,
故答案为:溶液稀释,c(Fe2+)降低;
③加入AgNO3,Ag+与I生成AgI黄色沉淀,I浓度降低,2Fe3++2I2Fe2++I2平衡逆向移动,可知Fe2+向Fe3+转化,
故答案为:i中Ag

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。
已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。
(1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
A | 青蒿素在水中的溶解度很大 | B | 青蒿素含有亲脂的官能团 |
C | 在低温下提取青蒿素,效果会更好 | D | 乙二醇提取青蒿素的能力强于乙醚 |
(2)用下列实验装置测定青蒿素实验式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
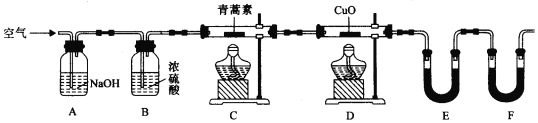
①装置D的作用是______,装置E中吸收的物质是______,装置F中盛放的物质是______。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是_____。
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
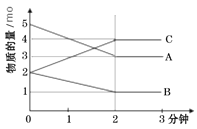
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)由图求得平衡时A的转化率为_______。
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
请完成此实验设计,其中:V1=_______,V6=_______。