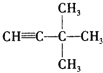
题目内容
【题目】下列关于Na2CO3和NaHCO3的性质比较中,不正确的是( )
A.热稳定性:Na2CO3>NaHCO3
B.常温下在水中的溶解性:NaHCO3>Na2CO3
C.等物质的量浓度的溶液与稀盐酸反应的产生气体的速率:Na2CO3>NaHCO3
D.等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3<NaHCO3
【答案】BC
【解析】
A.因2NaHCO3 ![]() Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故A正确;
Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故A正确;
B.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,NaHCO3<Na2CO3,故B错误;
C.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,产生气体的速率:Na2CO3<NaHCO3,故C错误;
D.设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、![]() mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、
mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、![]() mol,即放出CO2的质量:Na2CO3<NaHCO3,故D正确;
mol,即放出CO2的质量:Na2CO3<NaHCO3,故D正确;
故答案为BC。

【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO 4 溶液中 Fe+Cu 2+ =Cu+Fe 2+ | 将Na加入到CuSO 4 溶液中 2Na+Cu 2+ =Cu+2Na + |
B | 铁和氯气反应2Fe+3Cl 2 | 镁和氯气反应Mg + Cl 2 |
C | 稀硫酸与NaOH溶液反应至中性 H + +OH - =H 2 O | 稀硫酸与Ba(OH)2溶液反应至中性 H + +OH - =H 2 O |
D | 向AlCl 3溶液中加入过量NaOH溶液 Al3+ +4OH- = AlO2- +2H2O | 向AlCl 3溶液中加入过量氨水 Al3+ +4OH- = AlO2- +2H2O |
A. A B. B C. C D. D
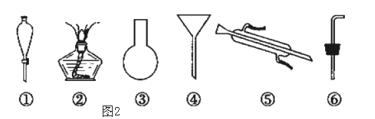
【题目】如图是中学化学中常用于混合物的分离和提纯装置,请根据装置回答问题:
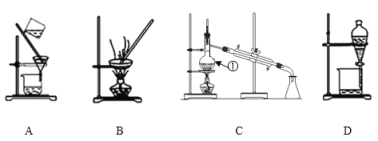
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是___。
(2)装置C中①的名称是___,此装置中冷凝水进出方向是___(填“上进下出”还是“下进上出”)。装置D中的分液漏斗在使用之前应该___,在分液时为使液体顺利滴下,应进行的具体操作是___。
(3)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择适当试剂按顺序添加 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是___(填化学式),证明溶液中SO42-已经除尽的方法是___。加入Na2CO3溶液的目的是___,所加入的试剂④可以是___(填化学式)。