ЬтФПФкШн
ЁОЬтФПЁПГЃЮТЯТЃЌвбжЊЃКKsp(AgCl)=1.8ЁС10-10ЃЌKsp(Ag2CrO4)=l.1ЁС10-12вдМАKsp[Cu(OH)2] =2ЁС10-20ЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
A. ГЃЮТЯТAgClБЅКЭШмвККЭAg2CrO4БЅКЭШмвКЕФЮяжЪЕФСПХЈЖШБШНЯЃКc(AgCl)<c(Ag2CrO4)
B. ГЃЮТЯТЃЌдк0.010molL-1ЕФAgNO3ШмвКжаЃЌAgClгыAg2CrO4ЗжБ№ФмДяЕНЕФзюДѓЮяжЪЕФСПХЈЖШБШНЯЃКc(AgCl)<c(Ag2CrO4)
C. ФГCuSO4ШмвКРяc(Cu2+)=0.02 molL-1ЃЌШчвЊЩњГЩCu(OH)2ГСЕэЃЌгІЕїећШмвКЕФpHЃЌЪЙжЎДѓгк5
D. вЊЪЙ0.2molL-1 CuSO4ШмвКжаCu2+ГСЕэНЯЮЊЭъШЋЃЈЪЙCu2+ХЈЖШНЕжСдРДЕФЧЇЗжжЎвЛЃЉЃЌдђгІЯђШмвКРяМгШыNaOHШмвКЃЌЪЙШмвКPHЮЊ6
ЁОД№АИЁПB
ЁОНтЮіЁПAбЁЯюЃЌAgCl(s)Ag+(aq)+Cl-(aq),c(AgCl)= ![]() =1.3ЁС10-5mol/LЃЛ
=1.3ЁС10-5mol/LЃЛ
Ag2CrO4(s)2Ag+(aq)+ CrO42-(aq),ЩшШмНтЕФAg2CrO4ХЈЖШЮЊx,дђKsp(Ag2CrO4)=x(2x)2=4x3,
c(Ag2CrO4)= ![]() =6.5ЁС10-5mol/LЃЛЫљвдc(AgCl)ЃМc(Ag2CrO4)ЁЃЙЪAе§ШЗЁЃBбЁЯюЃЌдк0.010mol/L AgNO3ШмвКжаЃЌAgCl(s)Ag+(aq)+Cl-(aq)ЃЌЩшШмвКЦНКтЪБШмНтЕФAgClХЈЖШЮЊx,дђ(0.010+x)ЁЄx=1.8ЁС10-10ЃЌxКмаЁЃЌЫљвд0.010+xЁж0.010ЃЌдђx=1.8ЁС10-8mol/LЃЌc(AgCl)=1.8ЁС10-8mol/LЃЛAg2CrO4(s)2Ag+(aq)+ CrO42-(aq)ЃЌЩшШмНтЦНКтЪБAg2CrO4ЕФХЈЖШЮЊy,дђ(0.010+2x)2ЁЄx=1.1ЁС10-10ЃЌвђЮЊxКмаЁЃЌЫљвд0.010+2xЁж0.010ЃЌдђx=1.1ЁС10-10mol/LЃЌЫљвдc(Ag2CrO4)=1.1ЁС10-10mol/LЁЃЫљвдc(AgCl)ЃОc(Ag2CrO4)ЃЌЙЪBДэЮѓЃЛCбЁЯюЃЌc(Cu2+)=0.02mol/LЃЌШчЙћЩњГЩCu(OH)2ГСЕэЃЌдђc(Cu2+) c2(OH-)ЃОKspЃЌЫљвдгІгаc(OH-)ЃО
=6.5ЁС10-5mol/LЃЛЫљвдc(AgCl)ЃМc(Ag2CrO4)ЁЃЙЪAе§ШЗЁЃBбЁЯюЃЌдк0.010mol/L AgNO3ШмвКжаЃЌAgCl(s)Ag+(aq)+Cl-(aq)ЃЌЩшШмвКЦНКтЪБШмНтЕФAgClХЈЖШЮЊx,дђ(0.010+x)ЁЄx=1.8ЁС10-10ЃЌxКмаЁЃЌЫљвд0.010+xЁж0.010ЃЌдђx=1.8ЁС10-8mol/LЃЌc(AgCl)=1.8ЁС10-8mol/LЃЛAg2CrO4(s)2Ag+(aq)+ CrO42-(aq)ЃЌЩшШмНтЦНКтЪБAg2CrO4ЕФХЈЖШЮЊy,дђ(0.010+2x)2ЁЄx=1.1ЁС10-10ЃЌвђЮЊxКмаЁЃЌЫљвд0.010+2xЁж0.010ЃЌдђx=1.1ЁС10-10mol/LЃЌЫљвдc(Ag2CrO4)=1.1ЁС10-10mol/LЁЃЫљвдc(AgCl)ЃОc(Ag2CrO4)ЃЌЙЪBДэЮѓЃЛCбЁЯюЃЌc(Cu2+)=0.02mol/LЃЌШчЙћЩњГЩCu(OH)2ГСЕэЃЌдђc(Cu2+) c2(OH-)ЃОKspЃЌЫљвдгІгаc(OH-)ЃО![]() mol/L=10-9mol/LЃЌдђc(H+)ЃМ10-5mol/LЃЌpHЃО5ЃЌЙЪCе§ШЗЃЛDбЁЯюЃЌ
mol/L=10-9mol/LЃЌдђc(H+)ЃМ10-5mol/LЃЌpHЃО5ЃЌЙЪCе§ШЗЃЛDбЁЯюЃЌ
ЪЙCu2+ХЈЖШНЕжСдРДЕФЧЇЗжжЎвЛЃЌМДCu2ЃЋЕФХЈЖШЮЊ2ЁС10-4mol/LЃЌИљОнKsp= c(Cu2+) c2(OH-),ПЩЕУc(OH-)=![]() mol/L=10-8mol/LЃЌдђc(H+)=10-6 mol/LЃЌМДpH=6ЃЌЙЪDе§ШЗЁЃЙЪбЁBЁЃ
mol/L=10-8mol/LЃЌдђc(H+)=10-6 mol/LЃЌМДpH=6ЃЌЙЪDе§ШЗЁЃЙЪбЁBЁЃ

 НнОЖбЕСЗМьВтОэЯЕСаД№АИ
НнОЖбЕСЗМьВтОэЯЕСаД№АИ аЁЗђзгШЋФмМьВтЯЕСаД№АИ
аЁЗђзгШЋФмМьВтЯЕСаД№АИЁОЬтФПЁПЯТЭМЪЧЪЕбщЪвжЦБИТШЦјВЂНјаавЛЯЕСаЯрЙиЪЕбщЕФзАжУЃЈМаГжМАМгШШвЧЦївбТдЃЉЁЃ
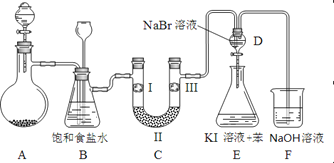
ЃЈ1ЃЉжЦБИТШЦјбЁгУЕФвЉЦЗЮЊЃКЦЏЗлОЋЙЬЬхЁОжївЊГЩЗжЮЊCaЃЈClOЃЉ2ЁПКЭХЈбЮЫсЃЌЯрЙиЕФЛЏбЇЗДгІЗНГЬЪНЮЊЃК______________________________________________ЁЃ
ЃЈ2ЃЉзАжУBжаБЅКЭЪГбЮЫЎЕФзїгУЪЧ____________ЃЛЭЌЪБзАжУBврЪЧАВШЋЦПЃЌМрВтЪЕбщНјааЪБCжаЪЧЗёЗЂЩњЖТШћЃЌЧыаДГіЗЂЩњЖТШћЪБBжаЕФЯжЯѓ_______________________ЁЃ
ЃЈ3ЃЉзАжУCЕФЪЕбщФПЕФЪЧбщжЄТШЦјЪЧЗёОпгаЦЏАзадЃЌЮЊДЫCжаIЁЂIIЁЂIIIвРДЮЗХШыЃК________ЁЃ
a | b | c | d | |
I | ИЩдяЕФгаЩЋВМЬѕ | ИЩдяЕФгаЩЋВМЬѕ | ЪЊШѓЕФгаЩЋВМЬѕ | ЪЊШѓЕФгаЩЋВМЬѕ |
II | МюЪЏЛв | ЙшНК | ХЈСђЫс | ЮоЫЎТШЛЏИЦ |
III | ЪЊШѓЕФгаЩЋВМЬѕ | ЪЊШѓЕФгаЩЋВМЬѕ | ИЩдяЕФгаЩЋВМЬѕ | ИЩдяЕФгаЩЋВМЬѕ |
ЃЈ4ЃЉЩшМЦзАжУDЁЂEЕФФПЕФЪЧБШНЯТШЁЂфхЁЂЕтЕФЗЧН№ЪєадЁЃЕБЯђDжаЛКЛКЭЈШызуСПТШЦјЪБЃЌПЩвдПДЕНЮоЩЋШмвКж№НЅБфЮЊКьзиЩЋЃЌЫЕУїТШЕФЗЧН№ЪєадДѓгкфхЁЃДђПЊЛюШћЃЌНЋзАжУDжаЩйСПШмвКМгШызАжУEжаЃЌеёЕДЁЃЙлВьЕНЕФЯжЯѓЪЧ____________________________ЁЃИУЯжЯѓ_______ЃЈЬюЁАФмЁБЛђЁАВЛФмЁБЃЉЫЕУїфхЕФбѕЛЏадЧПгкЕтЃЌдвђЪЧ___________ЁЃ
ЁОЬтФПЁПИпДПОЇЬхЙшЪЧаХЯЂММЪѕЕФЙиМќВФСЯЁЃ
ЃЈ1ЃЉЙшдЊЫиЮЛгкжмЦкБэЕФ__________жмЦк_________зхЁЃЯТУцгаЙиЙшВФСЯЕФЫЕЗЈжае§ШЗЕФЪЧ________(ЬюзжФИ)ЁЃ
A.ЬМЛЏЙшЛЏбЇаджЪЮШЖЈЃЌПЩгУгкЩњВњФЭИпЮТЫЎФр
B.ЕЊЛЏЙшгВЖШДѓЁЂШлЕуИпЃЌПЩгУгкжЦзїИпЮТЬеДЩКЭжсГа
C.ИпДПЖШЕФЖўбѕЛЏЙшПЩгУгкжЦдьИпадФмЭЈбЖВФСЯЙтЕМЯЫЮЌ
D.ЦеЭЈВЃСЇЪЧгЩДПМюЁЂЪЏЛвЪЏКЭЪЏгЂЩАжЦГЩЕФЃЌЙЪдкВЃСЇМтПкЕуШМH2ЪБГіЯжЛЦЩЋЛ№бц
E. бЮЫсПЩвдгыЙшЗДгІЃЌЙЪВЩгУбЮЫсЮЊХзЙтвКХзЙтЕЅОЇЙш
ЃЈ2ЃЉЙЄвЕЩЯгУЪЏгЂЩАКЭНЙЬППЩжЦЕУДжЙшЁЃ
вбжЊЃК

ЧыНЋвдЯТЗДгІЕФШШЛЏбЇЗНГЬЪНВЙГфЭъећЃКSiO2(s)+2C(s)ЈTSi(s)+2CO(g) ЁїH=_____________
ЃЈ3ЃЉДжЙшОЯЕСаЗДгІПЩЩњГЩЙшЭщ(SiH4)ЃЌЙшЭщЗжНтЩњГЩИпДПЙшЃЎвбжЊЙшЭщЕФЗжНтЮТЖШдЖЕЭгкМзЭщЃЌгУдзгНсЙЙНтЪЭЦфдвђЃК________________________________ЃЌSiдЊЫиЕФЗЧН№ЪєадШѕгкCдЊЫиЃЌЙшЭщЕФШШЮШЖЈадШѕгкМзЭщЁЃ
ЃЈ4ЃЉНЋДжЙшзЊЛЏГЩШ§ТШЧтЙш(SiHCl3)ЃЌНјвЛВНЗДгІвВПЩжЦЕУИпДПЙшЁЃ
ЂйSiHCl3жаКЌгаЕФSiCl4ЁЂAsCl3ЕШдгжЪЖдОЇЬхЙшЕФжЪСПгагАЯьЃЎИљОнЯТБэЪ§ОнЃЌПЩгУ_________________ЗНЗЈЬсДПSiHCl3ЁЃ
ЮяжЪ | SiHCl3 | SiCl4 | AsCl3 |
ЗаЕу/Ёц | 32.0 | 57.5 | 131.6 |
ЂкгУSiHCl3жЦБИИпДПЙшЕФЗДгІЮЊSiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)ЃЌВЛЭЌЮТЖШЯТЃЌSiHCl3ЕФЦНКтзЊЛЏТЪЫцЗДгІЮяЕФЭЖСЯБШЃЈЗДгІГѕЪМЪБЃЌИїЗДгІЮяЕФЮяжЪЕФСПжЎБШЃЉЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ_____________________ЃЈЬюзжФИађКХЃЉЁЃ
Si(s)+3HCl(g)ЃЌВЛЭЌЮТЖШЯТЃЌSiHCl3ЕФЦНКтзЊЛЏТЪЫцЗДгІЮяЕФЭЖСЯБШЃЈЗДгІГѕЪМЪБЃЌИїЗДгІЮяЕФЮяжЪЕФСПжЎБШЃЉЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ_____________________ЃЈЬюзжФИађКХЃЉЁЃ
a.ИУЗДгІЕФЦНКтГЃЪ§ЫцЮТЖШЩ§ИпЖјдіДѓ
b.КсзјБъБэЪОЕФЭЖСЯБШгІИУЪЧ![]()
C.ЪЕМЪЩњВњжаЮЊЬсИпSiHCl3ЕФРћгУТЪЃЌгІЪЪЕБЩ§ИпЮТЖШ
ЂлећИіжЦБИЙ§ГЬБиаыбЯИёПижЦЮоЫЎЮобѕЁЃSiHCl3гіЫЎОчСвЗДгІЩњГЩH2SiO3ЁЂHC1КЭСэвЛжжЮяжЪЃЌаДГіХфЦНЕФЛЏбЇЗДгІЗНГЬЪНЃК____________________________________ЁЃ