题目内容
13.实验室里需要用480mL 0.1mol•L-1的硫酸铜溶液.试回答钙溶液配置过程中的下列问题.(1)需要用托盘天平称取8.0g无水硫酸铜粉末,首先用适量水在烧杯中溶解配成溶液,然后再转移到某规格的容量瓶中.
(2)配置该溶液除了上述仪器外,还要用到的玻璃仪器有500mL容量瓶、玻璃棒、胶头滴管.
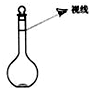
(3)在溶液配制过程中,某同学观察液面的情况如图所示,所配溶液浓度会偏高(填“偏高”、“偏低”或“无影响”).
分析 (1)需要用480mL 0.1mol•L-1的硫酸铜溶液,应选择500mL容量瓶,依据m=CVM计算溶质的质量;
(2)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)需要用480mL 0.1mol•L-1的硫酸铜溶液,应选择500mL容量瓶,需要称取硫酸铜的质量=0.5L×0.1mol•L-1×160g/mol=8.0g,故答案为:8.0;
(2)需要用480mL 0.1mol•L-1的硫酸铜溶液,实际应配制500ml,配制500mL 0.1mol•L-1的硫酸铜溶液,所需仪器:烧杯、天平、药匙、胶头滴管、量筒外、500mL容量瓶、玻璃棒;
所以还需要的仪器为:500mL容量瓶、玻璃棒、胶头滴管;
故答案为:500mL容量瓶、玻璃棒、胶头滴管;
(3)俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知溶液的浓度偏高,故答案为:偏高.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,明确配制一定物质的量浓度原理和操作步骤,侧重考查学生对实验基本知识的掌握情况,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
3.经测定,由C3H7OH和C6H12组成的混合物中氢的质量分数为14%,则此混合物中碳的质量分数为( )
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
1.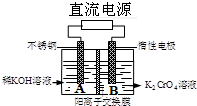 如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
 如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )| A. | 随着反应进行,阴极PH逐渐减小 | |
| B. | OH-通过隔膜进入B池 | |
| C. | B池电极发生反应为2H2O+4e-4═H++O2↑ | |
| D. | 每转移2mol电子生成2g H2 |
18.引燃密闭窒器中的已烷和O2组成的混合气,发生不完全燃烧,在120℃时测得反应前后气体压强分别是108kPa和156kPa,判断这一燃绕反应迸行的主要方向是( )
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |

 .
.