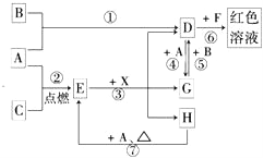
题目内容
【题目】(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是___(填标号)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是_______(填标号)
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____(填标号)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
【答案】 B A D
【解析】(1)根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2.由此可见:该元素原子中共有39个电子,分5个电子层,其中M能层上有18个电子,最外层上有2个电子。A.该元素原子处于能量最低状态时,原子中共有1未成对电子,选项A错误;B.该元素原子核外有5个电子层,选项B正确;C.该元素原子M能层共有18个电子,选项C错误;D.该元素原子最外层上有2个电子,选项D错误。答案选B;(2)A、键能越大,共价键越牢固,不易被破坏,故分子越稳定,选项A正确;B、H2O是一种非常稳定的化合物,与H-O键有关,而与氢键无关,选项B错误;C、水分子中中心原子O为sp3杂化,O中有两对孤电子对,根据孤电子对相斥理论,H2O分子的键角不是109°28′,而是104.5°,选项C错误;D、大部分分子有共价键,但是,稀有气体都是单分子单质,没有共价键,选项D错误。答案选A;(3)NF3分子中N原子的价层电子对个数=3+![]() ×(5-3×1)=4,且含有一个孤电子对,所以该分子是三角锥形结构,中心原子采用sp3杂化。答案选D。
×(5-3×1)=4,且含有一个孤电子对,所以该分子是三角锥形结构,中心原子采用sp3杂化。答案选D。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】一定条件下将质量m g的有机物在氧气中完全燃烧,燃烧后全部产物缓慢通过足量过氧化钠,充分反
应后过氧化钠固体增重n g,关于下列情况说法正确的是
有机物 | n | |
A | CH4 | 2m |
B | HCHO | 3m/2 |
C | CH3OH和CH3COOH的混合物 | 2m/3 |
D | C2H5OH和CH3COOC2H5的混合物 | m |
A. A B. B C. C D. D
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢