题目内容
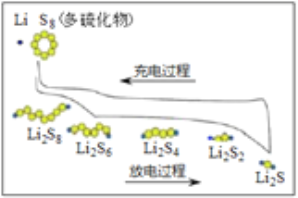
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
【答案】C
【解析】A. 充电时,是电解池,是电能转化为化学能,故A正确;B. 放电时,是原电池,在原电池中,阳离子向正极移动,因此锂离子向正极移动,故B正确;C. 根据图示,放电时,1mol Li2S6转化为Li2S4的反应为2Li2S6+ 2Li =3Li2S4,反应中2mol Li2S6得到2mole-,即1mol Li2S6得到1mole-,故C错误;D. 根据16Li+S8 ![]() 8Li2S,充电时,阳极总电极反应式是8S2- -16e- = S8,故D正确;故选C。
8Li2S,充电时,阳极总电极反应式是8S2- -16e- = S8,故D正确;故选C。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目