题目内容
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1) Cu+的价电子轨道表示式为_______; Cu2O与Cu2S比较,晶格能较大的是_______.
(2)新制的Cu(OH)2能够溶于过量浓碱溶液中,反应的离子方程式为______。
(3) SO2中心原子的价层电子对数目为_______, SO2分子构型为_________。
(4)将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图I所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S一O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。


(5)CuFeS2的晶胞如上图Ⅱ所示。CuFeS2的晶胞中与Cu原子距离最近且相等的Fe原子有____个;其晶体密度ρ=______g·cm-3 (列出表达式即可)。
【答案】 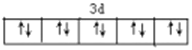 Cu2O Cu(OH)2+2OH-=[Cu(OH)4]2- 3 V形 sp3 a 8
Cu2O Cu(OH)2+2OH-=[Cu(OH)4]2- 3 V形 sp3 a 8 ![]()
【解析】(1) Cu+的价电子为3d10,轨道表示式为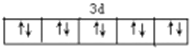 ,Cu2O与Cu2S比较,氧原子比硫原子半径小,离子间作用力大,故晶格能较大的是Cu2O;(2)新制的Cu(OH)2能够溶于过量浓碱溶液中,生成四羟基合铜离子,反应的离子方程式为Cu(OH)2+2OH-=[Cu(OH)4]2-;(3) SO2中心原子的价层电子对数目为(6-2×2)/2+2=3,中心原子硫原子为sp2杂化,SO2分子构型 V形;(4)固态SO3中S原子形成4个σ键,杂化轨道类型是sp3 ,该结构中S一O键长有两类,一类键长约140pm,是S=O双键,另一类键长约为160pm,是S―O单键,较短的键为a,是S=O双键;(5)CuFeS2的晶胞如上图Ⅱ所示。CuFeS2的晶胞中与Cu原子距离最近且相等的Fe原子有8个,如图所示
,Cu2O与Cu2S比较,氧原子比硫原子半径小,离子间作用力大,故晶格能较大的是Cu2O;(2)新制的Cu(OH)2能够溶于过量浓碱溶液中,生成四羟基合铜离子,反应的离子方程式为Cu(OH)2+2OH-=[Cu(OH)4]2-;(3) SO2中心原子的价层电子对数目为(6-2×2)/2+2=3,中心原子硫原子为sp2杂化,SO2分子构型 V形;(4)固态SO3中S原子形成4个σ键,杂化轨道类型是sp3 ,该结构中S一O键长有两类,一类键长约140pm,是S=O双键,另一类键长约为160pm,是S―O单键,较短的键为a,是S=O双键;(5)CuFeS2的晶胞如上图Ⅱ所示。CuFeS2的晶胞中与Cu原子距离最近且相等的Fe原子有8个,如图所示 ,由面心上Cu与2个S相连,晶胞中每个Cu与4个S相连;8个S均在体内,由化学式CuFeS2,则晶胞质量为
,由面心上Cu与2个S相连,晶胞中每个Cu与4个S相连;8个S均在体内,由化学式CuFeS2,则晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,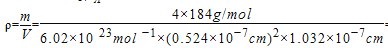

【题目】根据下列实验操作,预测的实验现象和实验结论或解释正确的是
实验操作 | 预测的实验现象 | 实验结论或解释 | |
A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+=H2O+CO2↑ |
B | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
A. A B. B C. C D. D