题目内容
【题目】综合利用CO2、CO对构建低碳社会有重要意义.
(1)固体氧化物电解池(SOEC)用于高温电解CO2和H2O的混合气体,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图.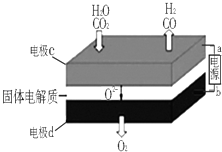
①b为电源的(填“正极”或“负极”)
②写出电极c发生的电极反应式、 .
(2)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g).对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2 , 达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 , 此时向容器中再通入0.35molCO气体,则此平衡将移动(填“向正反应方向”、“不”或“逆反应方向”).
【答案】
(1)正极;CO2+2e﹣=CO+O2﹣;H2O+2e﹣=H2+O2﹣
(2)50;逆反应方向
【解析】解:(1)①CO2+H2O ![]() CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,所以答案是:正极;
CO+H2+O2 , 二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,所以答案是:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 水中的氢元素化合价降低被还原,电极反应式为:H2O+2e﹣=H2+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣;H2O+2e﹣=H2+O2﹣;
(2)
CO(g) | + | 2H2(g) | CH3OH(g) | ||
起始: | 1.2mol | 1mol | 0 | ||
转化 | 0.4mol | 0.8mol | 0.4mol | ||
平衡 | 0.8mol | 0.2mol | 0.4mol |
所以:k= ![]() =50(mol/L)﹣2 ,
=50(mol/L)﹣2 ,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L× ![]() =2.5L,则浓度商Qc=
=2.5L,则浓度商Qc=  =54.3,大于平衡常数50,平衡向逆反应方向移动,
=54.3,大于平衡常数50,平衡向逆反应方向移动,
所以答案是:50;逆反应方向.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)已知:FeO(s)+CO(g)FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
T(K) | 938 | 1100 |
K | 0.68 | 0.40 |
①该反应平衡常数的表达式是 .
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量(填“增大”、“减小”或“不变”)曰该反应正反应是反应(填“吸热”或“放热”).
(2)常温下,下列溶液的浓度均为0.1molL﹣1 , 测得溶液pH值如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①由表中数据分析,上述溶质中的阴离子水解程度最小的是(填离子符号).
②由表中数据分析,0.01molL﹣1的下列溶液,酸性最弱的是(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么? . (请结合化学反应简要说明)