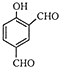
��Ŀ����
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
��1����֪��1molH2��1molO2��Һ̬ˮ��1molO��H��ʹ֮��Ϊ��̬ԭ������������ֱ�Ϊ436kJ��496kJ��462kJ��CH3OH��g����ȼ����Ϊ627kJmol��1��CO2��g��+3H2��g���TCH3OH��g��+H2O��l����H=kJmol��1
��2����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2��g��+6H2��g���TCH3OCH3��g��+3H2O��l��
�ٸ÷�Ӧƽ�ⳣ������ʽK=��
��3����֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ��ʾ���÷�Ӧ�ġ�H0������������������¶Ȳ��䣬��С��ӦͶ�ϱ�[ ![]() ]����K�������������С�����䡱����
]����K�������������С�����䡱���� 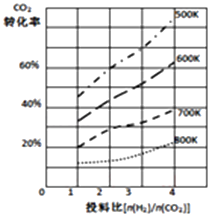
��4��ij�¶��£������һ�����ܱ�������ͨ��CO2��g����H2��g������������Ӧ�����������������ٷ����仯ʱ���ܱ����������淴Ӧ�ﵽ��ѧƽ�������
A.������̼��Ũ��
B.�����е�ѹǿ
C.������ܶ�
D.CH3OCH3��H2O�����ʵ���֮�ȣ�
���𰸡�
��1����93
��2��![]()
��3����������
��4��ABC
���������⣺��1.���跴Ӧ�ķ�Ӧ��ΪxkJmol��1 �� ���ݼ״���ȼ����д����CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��627kJmol��1 �� ���CO2��g��+3H2��g��=CH3OH��g��+H2O��l����H=xkJmol��1���ø�˹���ɿɵã�3H2��g��+
O2��g��=CO2��g��+2H2O��l����H=��627kJmol��1 �� ���CO2��g��+3H2��g��=CH3OH��g��+H2O��l����H=xkJmol��1���ø�˹���ɿɵã�3H2��g��+ ![]() O2��g��=3H2O��l����H=��627kJmol��1+xkJmol��1 �� ��436kJ��3+496kJ��
O2��g��=3H2O��l����H=��627kJmol��1+xkJmol��1 �� ��436kJ��3+496kJ�� ![]() ��462kJ��6=��627kJ+xkJ����ã�x=��93�����Դ��ǣ���93��
��462kJ��6=��627kJ+xkJ����ã�x=��93�����Դ��ǣ���93��
��2.��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������ƽ�ⳣ��K= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��3.����Ϊ�¶�Խ�ߣ�CO2ת����ԽС����ƽ�����ƣ����Ը÷�Ӧ������Ϊ���ȷ�Ӧ������H��0��Kֻ���¶�Ӱ�죬���¶Ȳ��䣬��СͶ�ϱȣ���K���䣬
���Դ��ǣ��������䣻
��4.��A��������̼��Ũ�Ȳ��䣬��ﵽ��ƽ�⣬��Aѡ��
B����Ӧǰ�������ϵ���Ͳ���ȣ���������ѹǿ���ٸı䣬��ﵽ��ƽ�⣬��Bѡ��
C���÷�Ӧ��һ����Ӧǰ����������仯�Ŀ��淴Ӧ��������������䣬����Ӧǰ�����������仯��������ܶȲ������仯����ﵽ��ƽ�⣬��Cѡ��
D���κ�ʱ��CH3OCH3��H2O�����ʵ���֮�Ȳ��䣬����˵����Ӧ�ﵽƽ�⣬��D��ѡ�����Դ��ǣ�ABC��
�����㾫�������շ�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ж��ǽ����ĸ�������Ҫ֪���ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

����Ŀ�����³����Լ���������ǣ� ��
ѡ�� | ���� | ���� | �����Լ� | ��Ӧ��������ӷ��� |
A | �� | ���� | �ռ���Һ | ��Һ |
B | �� | �� | ϡ���� | ���� |
C | ���� | �Ȼ��� | ����ʳ��ˮ | ϴ�� |
D | ���� | ��ϩ | ���� | ���������� |
A.A
B.B
C.C
D.D
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է� | �ܶ� | �е�/�� | �ܽ�� |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |
�������£�
����50mLԲ����ƿ�У�����18.5mL��������13.4mL�����ᣬ3��4��Ũ���ᣬͶ���ʯ����װ��ˮ�������ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ�������������ܣ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10% Na2CO3ϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣���15.1g������������
��ش��й����⣺
��1����ˮӦ�ô����������a����b�����˹ܿ�ͨ�룮
��2�����з�Һ����ʱ��ʹ�õ�©��������ѡ���
��3������A��������������Ʊ������������Ļ�ѧ����Ϊ ��
��4������١����Ϸ����ȥ��Ӧ���ɵ�ˮ����Ŀ���� ��
��5�����������10% Na2CO3��Һϴ���л��㣬�ò�������Ŀ����
��6�������������IJ���Ϊ ��
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO��g��+2H2��g��CH3OH��g����H1
��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H2=��58kJ/mol
��CO2��g��+H2��g��CO��g��+H2O��g����H3
�ش��������⣺
��1�����ʵı��������dz��õĻ�ѧ����ѧ���ݣ������������㻯ѧ��Ӧ�ȣ�����ѧ��Ӧ�ȣ���H=��������������ۺϩ���Ӧ����������ܺͣ�
��֪�������ʵı������������
���� | CO | CO2 | H2 | CH3OH��g�� |
�������ȣ�kJ/mol�� | ��110.52 | ��393.51 | 0 | ��201.25 |
A�������H1=kJ/mol B����H30����=����������
��2���ɼ״���һ���������Ʊ����ѣ�һ���¶��£������������Ϊ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH��g��CH3OCH3��g��+H2O��g����ʵ�����ݼ�����
������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |||
CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | CH3OCH3��g�� | H2O��g�� | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
����˵����ȷ����
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������a�е�CH3OH�������������b�е�С
C.����a�з�Ӧ����ƽ������ʱ�������c�еij�
D.����ʼʱ������a�г���CH3OH 0.15mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
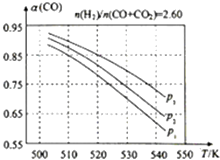
��3���ϳ�������� ![]() =2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
=2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
�٦���CO��ֵ���¶����߶��������С��������ԭ���� ��
��ͼ��P1��P2��P3�Ĵ�С��ϵΪ �� ���ж������� ��
��4���״������Ƴ�ȼ�ϵ�أ���ϳ����Ƴ�ȼ�ϵ������ŵ��ǣ�������������Ϊ������为����ӦΪ�� ��