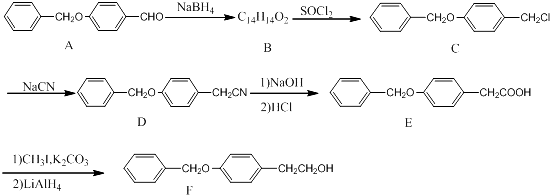
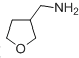
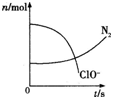
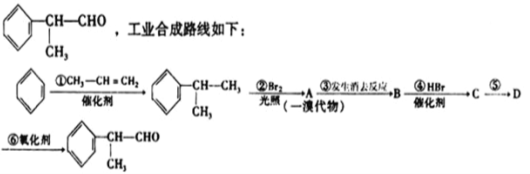
��Ŀ����
����Ŀ���������ʮ�־�Ŀ���DZ����������ԴӺ�ˮ�л�ö������ʡ�
��1�����辭����ѧ�仯���ܴӺ�ˮ�л�õ�һ��������________________________
��2��������������ʣ���Ũ����ˮ�к��д�����Mg2+,������ȡ����þ���������£�

�ٱ��ǵ���Ҫ�ɷ���CaCO3��ȼ�ձ���ʱ������Ӧ�Ļ�ѧ����ʽ��____________________________���ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��________________________��
�ڹ��˺���Mg(OH)2�м���________________���õ�MgCl2��Һ���ھ���һϵ�в����õ�MgCl2��
�۵������MgCl2�õ�þ������ͬʱ����___________ ________________�������������������е�_____________________________���裬�������ĺô���__________________________,þ������ȴ��Ϊ����þ����ȴþ����ʱ�����������������Χ�н���__________���������
A��H2 B��O2 C������
�������뺬þ�����йصIJ����У������������IJ�����_____________,ԭ����_____________��
���𰸡���1��NaCl ��2����CaCO3![]() CaO+CO2����Mg2++2OH-=Mg(OH)2��
CaO+CO2����Mg2++2OH-=Mg(OH)2��
������ ��Cl2 �������Ȼ��� ��Լԭ�� A �ܵ�� ���Ĵ�������
��������
�����������1������ͨ����ˮɹ�����NaCl���÷���û�����������ɣ����������仯���������辭����ѧ�仯���ܴӺ�ˮ�л�õ�һ��������NaCl��
��2���ٱ��ǵ���Ҫ�ɷ���CaCO3��̼������ȷֽ����������ƺͶ�����̼������ȼ�ձ���ʱ������Ӧ�Ļ�ѧ����ʽ��CaCO3![]() CaO+CO2������������ˮ��Ӧ����Ca(OH)2�����ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��Mg2++2OH-=Mg(OH)2����
CaO+CO2������������ˮ��Ӧ����Ca(OH)2�����ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��Mg2++2OH-=Mg(OH)2����
���ɼ������οɼ����ᣬ���˺���Mg(OH)2�м�������ɵõ�MgCl2��Һ������һϵ�в����õ�MgCl2��
�۵������MgCl2�õ�þ������������Cl2����������������Ӧ������HCl��HCl����ˮ�������ᣬ�����������������������е������Ȼ������裬�������ĺô�����Լԭ��,þ������ȴ��Ϊ����þ��þ���ʻ��ã����Ժ������������еĵ�����������CO2��Ӧ������ȴþ����ʱ����������Χ�н�������ѡA��
������������������Ĺ������̣����������뺬þ�����йصIJ����У������������IJ�������⣬ԭ�������Ĵ������ܡ�

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�