题目内容
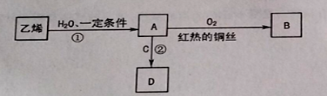
【题目】乙烯是一种重要的化工原料,可进行如下转化,其中C是食醋的主要成分。(部分反应物、生成物和反应条件已略去)
请回答下列问题。
(1)反应①的化学方程式是____________________________。
(2)B的结构简式是______________ ,C中官能团的名称是______________。
(3)反应②的化学方程式是_____________,反应类型是______________,反应后可用______________除去D中混有的C。
(4)鉴别乙烯和甲烷的方法是______________,若观察到______________,则证明气体是乙烯。
【答案】(1)CH2=CH2+H2O![]() C2H5OH
C2H5OH
(2)CH3CHO 羧基
(3)CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
(4)将气体分别通入酸性高锰酸钾溶液中 酸性高猛酸钾溶液褪色
【解析】
试题分析:(1)乙烯与水在一定条件下发生加成反应生成乙醇,化学方程式为CH2=CH2+H2O![]() C2H5OH。
C2H5OH。
(2)乙醇在铜作催化剂加热的条件下与氧气反应生成乙醛,乙醛的结构简式是CH3CHO;食醋的主要成分是乙酸,乙酸的官能团为羧基。
(3)乙酸与乙醇在浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3COOH +C2H5OH ![]() CH3COOC2H5+H2O;乙酸与碳酸钠溶液反应,而乙酸乙酯不反应,则乙酸乙酯中混有乙酸可用饱和碳酸钠溶液除去。
CH3COOC2H5+H2O;乙酸与碳酸钠溶液反应,而乙酸乙酯不反应,则乙酸乙酯中混有乙酸可用饱和碳酸钠溶液除去。
(4)乙烯能与酸性高猛酸钾溶液反应,而乙烷不能,所以鉴别乙烯和甲烷的方法是将气体分别通入酸性高锰酸钾溶液中,若观察到酸性高猛酸钾溶液褪色,则证明气体是乙烯。

练习册系列答案
相关题目