题目内容
【题目】如图所示,将铁棒和石墨棒插入1 L 浓度为1 mol·L-1食盐水中。下列说法正确的是( )
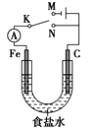
A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,将石墨棒换成铝片,可实现铁棒上镀铝
D. 若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
【答案】D
【解析】若电键K与N连接,形成铁-石墨-NaCl电池,相当于发生铁的吸氧腐蚀。铁为负极,反应为Fe-2e-=Fe2+,石墨为正极,反应为2H2O+O2+4e-===4OH-,所以选项A和选项B都错误。若电键K与M连接,将石墨棒换成铝片,不可能实现铁棒上镀铝,因为Al3+的反应顺序在H+的后面,所以是氢离子得电子转化为氢气,不会析出单质铝。选项C错误。若电键K与M连接,该装置是电解饱和食盐水,总反应为:2NaCl + 2H2O ![]() 2NaOH + H2↑+Cl2↑,所以电解时在两极上得到物质的量相同的氢气和氯气。当两极共产生28 L(标准状况下为1.25mol)气体时,氢气和氯气各为0.625mol,生成的氢氧化钠应该为1.25mol,选项D错误。
2NaOH + H2↑+Cl2↑,所以电解时在两极上得到物质的量相同的氢气和氯气。当两极共产生28 L(标准状况下为1.25mol)气体时,氢气和氯气各为0.625mol,生成的氢氧化钠应该为1.25mol,选项D错误。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A. 氮气分子的电子式是:N::N:
B. 苯的结构简式是C6H6
C. 中子数为18的氯原子符号是18Cl
D. 用电子式表示NaCl的形成过程是![]()
【题目】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________,作用是____________________________。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________(填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
滴定前体积/mL | 滴定后体积/mL | |
笫一次 | 0.33 | 20.32 |
笫二次 | 1.25 | 23.26 |
笫=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为________mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________(填“偏大”或“偏小”),此时应将量气筒的位置_______(填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。

