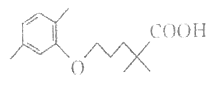��Ŀ����
����Ŀ����֪��
��.A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ���Ǻ���һ������ʯ�ͻ���ˮƽ�ı���
��.2CH3CHO��O2��2CH3COOH��
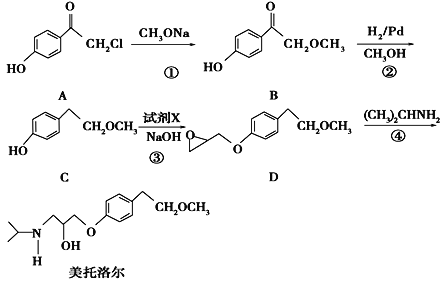
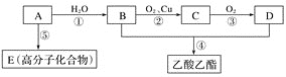
����AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ��ʾ��
��ش��������⡣
(1)д��A�Ľṹ��ʽ��___��
(2)B���ʵ�������___��
(3)E___(��ܻ��ܡ�)ʹ���Ը��������Һ��ɫ
(4)д�����з�Ӧ����ʽ����Ӧ���ͣ�
�ڻ�ѧ����ʽ__����Ӧ����___��
�ܻ�ѧ����ʽ__����Ӧ����___��
���𰸡�CH2=CH2 �Ҵ� ���� 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ������Ӧ CH3CH2OH+CH3COOH
2CH3CHO+2H2O ������Ӧ CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O ������Ӧ��ȡ����Ӧ
CH3COOC2H5+H2O ������Ӧ��ȡ����Ӧ
��������
A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ������һ�����ҵ�ʯ�ͻ���ˮƽ����AӦΪ��ϩCH2=CH2����ϩ��ˮ��һ�������·����ӳɷ�Ӧ����CH3CH2OH���Ҵ���Cu��Ag�����������·���������ӦCH3CHO��CH3CHO�ɽ�һ������ΪCH3COOH��CH3CH2OH��CH3COOH��Ũ���������·�Ӧ��������������������ϩ�к���C=C����һ�������·����Ӿ۷�Ӧ����E����ϩ����AΪCH2=CH2��BΪCH3CH2OH��CΪCH3CHO��DΪCH3COOH��EΪ����ϩ���ݴ˻ش�
(1)���ݷ�����AΪ��ϩ���ṹ��ʽΪ��CH2=CH2��
(2) BΪCH3CH2OH���������Ҵ���
(3)E�Ǿ���ϩ![]() ���ṹ�в���̼̼˫�������Բ���ʹ���Ը��������Һ��ɫ��
���ṹ�в���̼̼˫�������Բ���ʹ���Ը��������Һ��ɫ��
(4)��Ϊ�Ҵ���Cu��Ag�����������·���������Ӧ����CH3CHO����ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O����Ӧ����Ϊ������Ӧ��
2CH3CHO+2H2O����Ӧ����Ϊ������Ӧ��
��ΪCH3CH2OH��CH3COOH��Ũ���������·�Ӧ����������������ѧ����ʽCH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O����Ӧ����Ϊ������Ӧ��ȡ����Ӧ��
CH3COOC2H5+H2O����Ӧ����Ϊ������Ӧ��ȡ����Ӧ��

 ������ҵ����ν�����������ϵ�д�
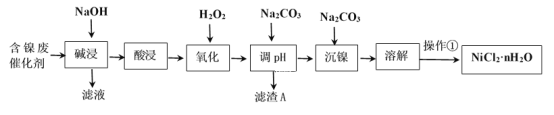
������ҵ����ν�����������ϵ�д�����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O��������ͼ��
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Al��ԭ�ӽṹʾ��ͼΪ___��
��2��������������ܽ�����ʹ�õ���Ϊ___���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��____��
��3��������������H2O2��Һ����������___(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����___Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
��5���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��