题目内容
(2010?上海)NA表示阿伏加德罗常数,下列叙述正确的是( )
分析:本题考查了阿伏伽德罗常数知识.主要考查点有:①判断一定量的物质所含的某种粒子数目的多少;②物质的组成;③通过阿伏加德罗常数进行一些量之间的换算;④气体摩尔体积
解答:解:A、阿伏伽德罗常数是指1mol任何微粒中含有的微粒数,等物质的量不一定是1mol,A错;
B、H2O2的相对分子质量为34,故1.7g的物质的量为0.05mol,其每个分子中含有的电子为18个,则其1.7g中含有的电子的物质的量为0.9mol,数目为0.9NA,B对;
C、Na2O2固体中,含有的是Na+和O22-两种离子,1mol固体中含有3mol离子,故其中的离子总数为3 NA,C错;
D、戊烷在标准状况下为液态,故其2.24L不是0.1mol,D错.
故选:B.
B、H2O2的相对分子质量为34,故1.7g的物质的量为0.05mol,其每个分子中含有的电子为18个,则其1.7g中含有的电子的物质的量为0.9mol,数目为0.9NA,B对;
C、Na2O2固体中,含有的是Na+和O22-两种离子,1mol固体中含有3mol离子,故其中的离子总数为3 NA,C错;
D、戊烷在标准状况下为液态,故其2.24L不是0.1mol,D错.
故选:B.
点评:判断一定量的物质所含有的某种粒子数目的多少是高考命题的热点之一.在平时的学习中要强化训练,并注意知识的积累和总结.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
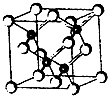 (2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答:
(2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答: