题目内容
(2010?上海)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)+190kJ
1)该反应所用的催化剂是
2)该热化学反应方程式的意义是
3)对于反应2SO2+O2?2SO3(g),化学平衡状态的标志为
a.v正(O2)=2v正(SO3)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
2SO2(g)+O2(g)?2SO3(g)+190kJ
1)该反应所用的催化剂是
五氧化二钒
五氧化二钒
(填写化合物名称),该反应450℃时的平衡常数大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).2)该热化学反应方程式的意义是
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ
.3)对于反应2SO2+O2?2SO3(g),化学平衡状态的标志为
bd
bd
a.v正(O2)=2v正(SO3)
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
0.036
0.036
mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.40
0.40
mol.分析:1)二氧化硫和氧气在五氧化二钒的催化作用下生成三氧化硫,平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应则相反;
2)热化学方程式应注明反应热的测定条件、聚集状态、反应热的数值、单位、符号,其化学计量数表示该物质的物质的量;
3)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
4,化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围.
2)热化学方程式应注明反应热的测定条件、聚集状态、反应热的数值、单位、符号,其化学计量数表示该物质的物质的量;
3)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
4,化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围.
解答:解:1)二氧化硫和氧气在五氧化二钒的催化作用下生成三氧化硫;化学平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应平衡常数随温度升高而减小,该反应为放热反应,450℃时的平衡常数大于500℃时的平衡常数;
2)热化学方程式表明化学反应所放出或吸收热量的化学方程式,反应热的测量与温度有关,应注明温度,各物质化学式前的化学计量数表示该物质的物质的量,反应物和生成物的聚集状态不同,反应热也不相同,应注明聚集状态,+190kJ表示放出190kJ的热量,该热化学方程式的意义是:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
3)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断,
a、v正(O2)=2v正(SO3)均为正反应速率,不能判断是否达到平衡;
b、容器中气体的平均分子量不随时间而变化,说明平衡混合物中各组成成分含量不变,反应达到平衡状态;
c、气体的密度=
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡;
d、该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态;
4)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2+O2
2SO3
1 2
x 0.18mol
=
x=0.09mol
v(O2)=
=0.036mol.L-1?min-1;
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2
2SO3可知n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol.
故答案为:1)五氧化二钒;大于;
2)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
3)bd;
4)0.036;向正反应方向;0.36;0.40.
2)热化学方程式表明化学反应所放出或吸收热量的化学方程式,反应热的测量与温度有关,应注明温度,各物质化学式前的化学计量数表示该物质的物质的量,反应物和生成物的聚集状态不同,反应热也不相同,应注明聚集状态,+190kJ表示放出190kJ的热量,该热化学方程式的意义是:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
3)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断,
a、v正(O2)=2v正(SO3)均为正反应速率,不能判断是否达到平衡;
b、容器中气体的平均分子量不随时间而变化,说明平衡混合物中各组成成分含量不变,反应达到平衡状态;
c、气体的密度=
| 质量 |
| 体积 |
d、该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态;
4)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2+O2
| V2O5 |
| △ |
1 2
x 0.18mol
| 1 |
| 2 |
| x |
| 0.18mol |
x=0.09mol
v(O2)=
| 0.09mol |
| 5L?0.5min |
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2
| V2O5 |
| △ |
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol.
故答案为:1)五氧化二钒;大于;
2)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
3)bd;
4)0.036;向正反应方向;0.36;0.40.
点评:本题考查化学反应速率、平衡常数、化学平衡状态的判断、化学平衡的影响因素等,知识面广,应加强平时知识的积累.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
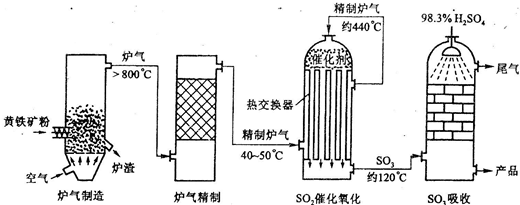
 硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.