题目内容
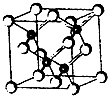 (2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答:
(2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答:(1)镓的基态原子的电子排布式是
ls22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
ls22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
.(2)砷化镓品胞中所包含的砷原子(白色球)个数为
4
4
,与同一个镓原子相连的砷原子构成的空间构型为正四面体
正四面体
.(3)下列说法正确的是
BCDE
BCDE
(填字母).A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是
NH3>AsH3>PH3
NH3>AsH3>PH3
.(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得.(CH3)3Ga中镓原子的杂化方式为
sp2
sp2
.分析:(1)镓是31号元素,根据基态原子核外电子排布式书写规则写出其基态原子核外电子排布式;
(2)利用均摊法计算晶胞中含有的砷原子;
(3)A、根据晶胞结构分析判断;
B、同一周期,元素的第一电离能随着原子序数的增大而增大,但第VA族的第一电离能大于第VIA族的第一电离能;
C、同一周期元素中,元素的电负性随着原子序数的增大而增大;
D、含有空轨道的原子和含有孤电子对的原子之间易形成配位键;
E、原子总数相同、价电子总数相同的分子为等电子体;
(4)同一主族元素中,氢化物的沸点随着原子序数的增大而增大,但含有氢键的氢化物的沸点最高;
(5)根据价层电子对个数确定杂化方式.
(2)利用均摊法计算晶胞中含有的砷原子;
(3)A、根据晶胞结构分析判断;
B、同一周期,元素的第一电离能随着原子序数的增大而增大,但第VA族的第一电离能大于第VIA族的第一电离能;
C、同一周期元素中,元素的电负性随着原子序数的增大而增大;
D、含有空轨道的原子和含有孤电子对的原子之间易形成配位键;
E、原子总数相同、价电子总数相同的分子为等电子体;
(4)同一主族元素中,氢化物的沸点随着原子序数的增大而增大,但含有氢键的氢化物的沸点最高;
(5)根据价层电子对个数确定杂化方式.
解答:解:(1)镓原子的价态核外电子排布式为:l s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
故答案为:l s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)砷原子(白色球)个数=8×
+6×
=4,根据晶胞结构知,每个镓原子连接4个砷原子,构成正四面体结构;
故答案为:4,正四面体;
(3)A.根据晶胞结构知,砷化镓品胞结构与NaCl不同,故错误;
B.第一电离能:As>Ga,故正确;
C.电负性:As>Ga,故正确;
D.砷提供孤电子对,镓提供空轨道,所以砷化镓晶体中含有配位键,故正确;
E.GaP与GaAs中原子总数相同、价电子数相同,所以互为等电子体,故正确;
故选BCDE;
(4)同一主族元素中,氢化物的沸点随着原子序数的增大而增大,但含有氢键的氢化物的沸点最高,NH3能形成氢键,沸点最高,N、P、As的氢化物沸点由高到低的顺序是NH3>AsH3>PH3;
故答案为:NH3>AsH3>PH3;
(5)(CH3)3Ga中镓原子含有3个σ 键,不含孤电子对,所以镓原子的杂化方式是sp2;
故答案为:sp2.
故答案为:l s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)砷原子(白色球)个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4,正四面体;
(3)A.根据晶胞结构知,砷化镓品胞结构与NaCl不同,故错误;
B.第一电离能:As>Ga,故正确;
C.电负性:As>Ga,故正确;
D.砷提供孤电子对,镓提供空轨道,所以砷化镓晶体中含有配位键,故正确;
E.GaP与GaAs中原子总数相同、价电子数相同,所以互为等电子体,故正确;
故选BCDE;
(4)同一主族元素中,氢化物的沸点随着原子序数的增大而增大,但含有氢键的氢化物的沸点最高,NH3能形成氢键,沸点最高,N、P、As的氢化物沸点由高到低的顺序是NH3>AsH3>PH3;
故答案为:NH3>AsH3>PH3;
(5)(CH3)3Ga中镓原子含有3个σ 键,不含孤电子对,所以镓原子的杂化方式是sp2;
故答案为:sp2.
点评:本题考查了原子的杂化方式、核外电子排布式的书写、物质熔沸点的判断等知识点,电子排布式的书写、原子的杂化方式是高考的热点,是学习的重点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
(2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )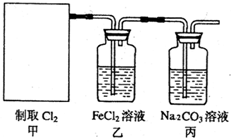 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.