题目内容
10.将密度为1.19g•cm-3,质量分数36.5%HC1 100mL与足量的MnO2反应,若上述盐酸的80%参加了反应,试计算:(1)生成Cl2物质的量;
(2)将这些Cl2通人足量的碘化钾溶液中能置换出多少克碘?
分析 (1)发生MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,结合c=$\frac{1000ρw%}{M}$、n=cV及反应计算;
(2)发生Cl2+2KI=2KCl+I2,结合反应及m=nM计算.
解答 解:(1)密度为1.19g•cm-3,质量分数36.5%HCl,c(HCl)=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,盐酸的80%参加了反应,则参加反应的HCl为0.1L×80%×11.9mol/L=0.952mol,由MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,生成氯气的物质的量为0.952mol×$\frac{1}{4}$=0.238mol,
答:生成Cl2物质的量为0.238mol;
(2)由Cl2+2KI=2KCl+I2可知,生成碘为0.238mol×254g/mol=60.452g,
答:生成碘为60.452g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.72号元素所在周期和族是( )
| A. | 第六周期ⅣB族 | B. | 第六周期ⅢB族 | C. | 第六周期0族 | D. | 第六周期ⅢA族 |
5.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-?H++A2-.现有体积各为10mL的下列四种溶液:
①0.02mol•L-1的H2A溶液
②0.02mol•L-1的NaHA溶液
③浓度均为0.02mol•L-1的Na2A溶液和NaHA的混合溶液
④0.02mol•L-1的Na2A溶液
下列关于上述四种溶液的说法不正确的是( )
①0.02mol•L-1的H2A溶液
②0.02mol•L-1的NaHA溶液
③浓度均为0.02mol•L-1的Na2A溶液和NaHA的混合溶液
④0.02mol•L-1的Na2A溶液
下列关于上述四种溶液的说法不正确的是( )
| A. | 在②的溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| B. | 四种溶液中离子总数的关系:④>③>②>① | |
| C. | 四种溶液中c(H+)的关系:①>②>③>④ | |
| D. | 在①的溶液中:c(H+)=c(HA-)+c(A2-)+c(OH-) |
2.锂电池以锂离子非水溶剂为电解质,锂为负极,Li2FeS2为正极.电池反应为2Li+FeS2═Li2FeS2.下列推断正确的是( )
| A. | 放电时.将电能转化成化学能 | |
| B. | 充电时,阳极反应为Li++e-═Li | |
| C. | 正极的电极反应式为FeS2+2e-+2Li+═Li2FeS2 | |
| D. | 每转移0.1mol电子,正极材料消耗12.0g |
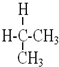 与
与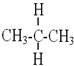 互为同分异构体
互为同分异构体 与
与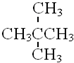 属于同系物
属于同系物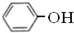 与
与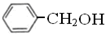 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体.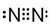 ;
; SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题:
SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题: