题目内容
9.设NA代表阿伏加德罗常数的值,N表示粒子数.下列叙述正确的是( )| A. | 将CO2通过Na2O2使其增重ag时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1molCl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2.24L的CH4中含有的C-H键数为0.4NA | |
| D. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA |
分析 A、将CO2通过Na2O2时,增重的是CO的质量,且当1mol二氧化碳反应时,转移1mol电子,增重1molCO的质量;
B、氯气与水的反应是可逆反应;
C、甲烷所处的状态不明确;
D、甲醛和冰醋酸的最简式均为HCHO.
解答 解:A、将CO2通过Na2O2时,增重的是CO的质量,且当1mol二氧化碳反应时,转移1mol电子,增重1molCO的质量即增重28g,故当增重ag时,转移的电子的物质的量为$\frac{a}{28}$mol,个数为$\frac{a{N}_{A}}{28}$个,故A错误;
B、氯气与水的反应是可逆反应,所得的氯水中有未反应的氯气分子,故根据氯的物料守恒有:2N(Cl2)+N(HClO)+N(Cl-)+N(ClO-)=2NA,故B错误;
C、甲烷所处的状态不明确,故气体摩尔体积的数值不明确,其物质的量和C-H键个数无法计算,故C错误;
D、甲醛和冰醋酸的最简式均为HCHO,故3.0g混合物中含有的HCHO的物质的量为n=$\frac{3.0g}{30g/mol}$=0.1mol,故共含0.4mol原子即0.4NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极.下列说法正确的是( )

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
4.下列有关叙述中正确的是( )
| A. | CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
1.72号元素所在周期和族是( )
| A. | 第六周期ⅣB族 | B. | 第六周期ⅢB族 | C. | 第六周期0族 | D. | 第六周期ⅢA族 |

 与
与 互为同分异构体
互为同分异构体 与
与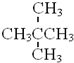 属于同系物
属于同系物 与
与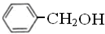 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体. 化学平衡原理是中学化学学习的重要内容.请回答下列问题:
化学平衡原理是中学化学学习的重要内容.请回答下列问题: ;
;