题目内容
20.如图1是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中可观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”.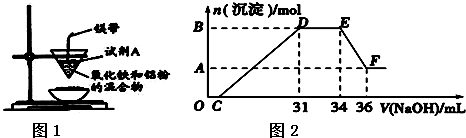
(1)试剂A的名称是氯酸钾
(2)探究铝热反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解,(假设固体全部溶解后溶液体积不变),反应过程中无气体放出(活泼金属可把稀 HNO3还原为NH4NO3).向反应后的溶液中缓慢滴加4mol•L-1的NaOH溶液,产生沉淀的物质的量与加入 NaOH溶液 的体积的关系如图2所示:
①写出DE段发生反应的离子方程式:NH4++OH-═NH3•H2O
②求c(HNO3)=1.48mol/L.③B与A的差值为0.008
(3)若铝和氧化铁能恰好完全反应.则该铝热剂与盐酸反应时转移电子与所耗H+的物质的量之比为1:2.
分析 (1)铝热反应中选用用氯酸钾做助燃剂;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3•H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,以此进行解答;
(3)由氧化铁粉末和铝粉反应的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,生成2mol的铁的同时产生1mol的氧化铝,所以转移物质的量为2×2:(3×2+2)=1:2.
解答 解:(1)氯酸钾加热分解生成氧气,铝热反应中需要用到氯酸钾,则A为氯酸钾,故答案为:氯酸钾;
(2)①OC发生H++OH-═H2O;CD反应生成氢氧化铝和氢氧化铁沉淀,D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,离子方程式为,NH4++OH-═NH3•H2O,
故答案为:NH4++OH-═NH3•H2O;
②加入34mLNaoH溶液时,溶质为硝酸钠,原溶液中硝酸转化为为硝酸钠和一水合氨两部分,
其中硝酸钠中消耗的硝酸为:4mol/L×34×10-3L=0.136mol;一水合氨的物质的量为:4mol/L×(34-31)×10-3L=0.012mol,
则硝酸的总物质的量为:0.136mol+0.012mol=0.148mol,硝酸溶液浓度为:$\frac{0.148mol}{0.1L}$=1.48mol/L,
故答案为:1.48mol/L;
③E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol,
所以B与A差值为0.008mol,
故答案为:0.008;
(3)由氧化铁粉末和铝粉反应的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,生成2mol的铁的同时产生1mol的氧化铝,所以转移物质的量为2×2:(3×2+2)=1:2,故答案为:1:2.
点评 本题考查了铝热反应、离子方程式计算,题目难度中等,注意掌握铝热反应原理,(2)为难点、易错点,明确图象曲线变化的含义为解答关键,试题培养了学生的分析、理解能力及化学实验、化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 两种不同的非金属元素形成的化合物中只存在极性共价键 | |
| C. | 共价化合物不可能存在离子键 | |
| D. | 某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键 |
| A. | Fe3+、Na+、OH-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Cu2+、Mg2+、CO32-、Cl- | D. | H+、Na+、MnO4-、SO32- |
| A. | 稀醋酸与0.1mol•L-1NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为110.5 kJ•mol-1 |
| A. | 溶液中加入稀HNO3后,再加AgNO3溶液有黄色沉淀生成,则溶液中一定含Br- | |
| B. | 溶液中加入BaCl2有白色沉淀,再加入稀硝酸沉淀不溶解,则溶液中一定含SO42- | |
| C. | 溶液中加入NaOH溶液,加热后能产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含NH4+ | |
| D. | 进行某溶液的焰色反应时,观察火焰呈黄色,则溶液中一定不存在K+ |
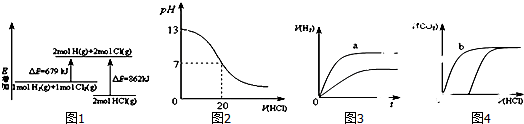
| A. | 图1表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ•mol-1 | |
| B. | 图2表示室温时用0.1mol•L-1盐酸滴定10mL0.1mol•L-1NaOH溶液,溶液pH随加入酸体积变化 | |
| C. | 图3表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示10mL0.1mol/LNa2CO3和NaHCO3两种溶液中,分别滴加0.1mol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
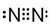 ;
; SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题:
SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3.请回答下列问题: