题目内容
【题目】将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )
A.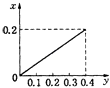
B.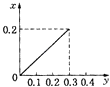
C.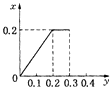
D.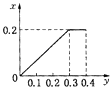
【答案】C
【解析】解:22.4g铁的物质的量为 ![]() =0.4mol,令铁完全反应需硝酸的物质的量为n,则:
=0.4mol,令铁完全反应需硝酸的物质的量为n,则:
Fe+ | 4HNO3(稀)=Fe(NO3)3+NO↑+2H2O |
1 | 4 |
0.4mol | n |
所以n=1.6mol,由于1.6mol>0.8mol,所以Fe有剩余,根据硝酸计算生成NO的物质的量,参加反应生成NO的Fe的物质的量,则:
Fe+ | 4HNO3(稀)=Fe(NO3)3 + | NO↑+2H2O |
1mol | 4 mol | 0.1mol |
0.2mol | 0.8mol | 0.2mol |
根据生成NO的物质的量,参加反应生成NO的Fe的物质的量作图,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系如图:
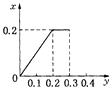
故选:C.
铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,开始硝酸过量,铁与硝酸反应生成硝酸铁、一氧化氮,当硝酸反应完毕后,铁若有剩余,再与硝酸铁反应生成硝酸亚铁.
先判断铁与硝酸反应生成硝酸铁、一氧化氮,铁是否有剩余,若铁有剩余根据硝酸计算生成NO的物质的量,若硝酸有剩余根据铁计算生成NO的物质的量.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】下表列举了部分元素在自然界和人体内的质量分数(%),下面的说法不正确的是( )
C | H | O | Fe | Ca | |
地壳 | 0.19 | 0.22 | 47 | 4.5 | 3.5 |
人体 | 9.4 | 63 | 25.5 | 0.01 | 0.31 |
A. 上表体现了生物界与非生物界的统一性
B. 上表体现了生物界与非生物界的差异性
C. 上表中列举的化学元素都是生命所必需的大量元素
D. 上表中列举的C、H、O、Fe、Ca是人体所必需的化学元素
【题目】碳元素在自然界中以多种形态存在。
I、下图A、B分别表示金刚石和石墨的结构模型。右表为金刚石和石墨的某些性质:
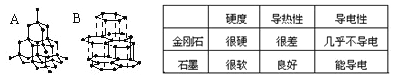
(1)金刚石转化为石墨属于_________变化(填“物理”或“化学”)。
(2)切割玻璃的玻璃刀应选用________________(填“金刚石”或“石墨”)做材料。
(3)根据金刚石和石墨的结构和性质推断,下述观点不正确的是___(填字母)
A.不同物质具有不同的结构 B.不同物质的组成元素一定不同
C.不同物质具有不同的性质 D.物质的结构决定了物质的性质
II、碳酸盐是碳的重要化合物。碳酸钠和碳酸氢钠是应用广泛的两种碳酸盐。
(4)碳酸氢钠在日常生活中的一种用途是____________________。
(5)现有一包白色固体,为检验该粉末是碳酸钠还是碳酸氢钠,某同学设计如下方案开展实验。请根据要求填写空白:
实验操作 | 有关反应的化学方程式 | 实验结论 |
取少许粉末置于试管中加热,并将产生的气体通入澄清石灰水。 | ______________________________________________________________________________ | 该粉末为 碳酸氢钠 |