题目内容
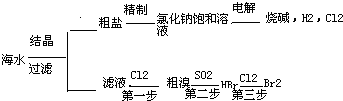
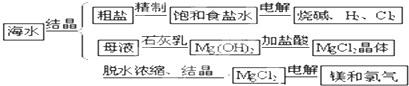
 海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种.下列物质不需要通过化学变化就能够从海水中获得的是
AC
AC
.A.食盐 B.金属钠 C.淡水
(2)以电解食盐水为基础制取Cl2、
H2、NaOH
H2、NaOH
等产品的工业称为“氯碱工业”.(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气
b
b
(填写装置的序号). 
(4)实验室中模拟Br-→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现.写出Br-→Br2的转化离子方程式为:
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是d
d
(选填下列选项的编号字母).
(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁.下列气体中,镁蒸气可以在其氛围中冷却的是
Ar、H2
Ar、H2
(选填下列选项的编号字母).A.Cl2 B.N2 C.Ar D.空气 E.H2.
分析:(1)把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐;海水中得到钠,需要首先从海水中获得氯化钠,然后再去电解熔融状态的氯化钠即得钠;
(2)电解饱和食盐水得到Cl2、H2和NaOH,我们称之为氯碱工业;
(3)根据反应物的状态和反应条件选择发生装置;
(4)根据氯气能氧化溴离子得到单质溴;根据氯气有毒,用注意尾气吸收;
(5)可以在其氛围中冷却镁蒸气,说明该气体与镁不反应;
(2)电解饱和食盐水得到Cl2、H2和NaOH,我们称之为氯碱工业;
(3)根据反应物的状态和反应条件选择发生装置;
(4)根据氯气能氧化溴离子得到单质溴;根据氯气有毒,用注意尾气吸收;
(5)可以在其氛围中冷却镁蒸气,说明该气体与镁不反应;
解答:解:(1)把海水用蒸馏等方法可以得到淡水,是物理变化;把海水用太阳暴晒,蒸发水分后即得食盐,是物理变化;海水中得到钠,需要首先从海水中获得氯化钠,然后再去电解熔融状态的氯化钠可制得钠,是化学方法;
故选:AC;
(2)电解饱和食盐水得到Cl2、H2和NaOH,我们称之为氯碱工业,
故答案为:H2、NaOH;
(3)实验室制取氯气用二氧化锰和浓盐酸,反应物是固体和液体,且需要加热,所以选择发生装置b;
故选:b;
(4)氯气能氧化溴离子得到单质溴,离子方程式为:2Br-+Cl2=2Cl-+Br2,氯气有毒,用注意尾气吸收,以防污染空气;
故答案为:2Br-+Cl2=2Cl-+Br2;d;
(5)能和金属镁发生反应的气体:Cl2、N2、空气,不能与金属镁发生反应的气体:Ar、H2,
故答案为:CE;
故选:AC;
(2)电解饱和食盐水得到Cl2、H2和NaOH,我们称之为氯碱工业,
故答案为:H2、NaOH;
(3)实验室制取氯气用二氧化锰和浓盐酸,反应物是固体和液体,且需要加热,所以选择发生装置b;
故选:b;
(4)氯气能氧化溴离子得到单质溴,离子方程式为:2Br-+Cl2=2Cl-+Br2,氯气有毒,用注意尾气吸收,以防污染空气;
故答案为:2Br-+Cl2=2Cl-+Br2;d;
(5)能和金属镁发生反应的气体:Cl2、N2、空气,不能与金属镁发生反应的气体:Ar、H2,
故答案为:CE;
点评:本题主要考查了物质的制备与性质,难度中等,根据所学知识即可完成.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目