题目内容
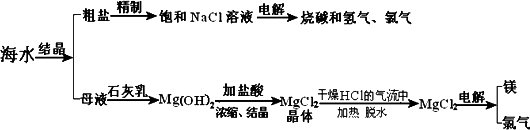
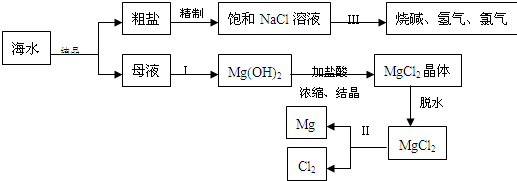
海水中含有非常丰富的化学资源,从海水中可提取多种化工原料.下图是某化工厂对海水资源综合利用的示意图.(注:母液中含有Mg2+)

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中加入以下物质,最后使溶液呈中性.
①过量的Na2CO3溶液、②盐酸、③过量的NaOH溶液、④过量的BaCl2溶液则,加入的顺序是
(2)写出加入最后一种试剂后可能发生的化学反应的离子方程式
(3)①写出反应Ⅱ的化学方程式
②写出反应Ⅲ的离子方程式

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中加入以下物质,最后使溶液呈中性.
①过量的Na2CO3溶液、②盐酸、③过量的NaOH溶液、④过量的BaCl2溶液则,加入的顺序是
④③①②或③④①②或④①③②
④③①②或③④①②或④①③②
.(2)写出加入最后一种试剂后可能发生的化学反应的离子方程式
H++OH-═H2O
H++OH-═H2O
、2H++CO32-═H2O+CO2↑
2H++CO32-═H2O+CO2↑
.(3)①写出反应Ⅱ的化学方程式
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
| ||
②写出反应Ⅲ的离子方程式
2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
.
| ||
分析:(1)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液.
(2)根据除杂试剂NaOH和Na2CO3过量能与盐酸反应;
(2)①根据反应步骤写出电解熔融氯化镁;
②根据电解饱和食盐水写出离子方程式;
(2)根据除杂试剂NaOH和Na2CO3过量能与盐酸反应;
(2)①根据反应步骤写出电解熔融氯化镁;
②根据电解饱和食盐水写出离子方程式;
解答:解:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为④③①②或③④①②或④①③②
(2)因NaOH和Na2CO3过量,能与盐酸反应,所以离子方程式为:H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①反应Ⅱ是电解熔融氯化镁,化学方程式为:MgCl2
Mg+Cl2↑;
②反应Ⅲ为电解饱和食盐水,离子方程式为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;
故答案为:(1)④③①②或③④①②或④①③②
(2)H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①MgCl2
Mg+Cl2↑
②2Cl-+2H2O
2OH-+Cl2↑+H2↑
(2)因NaOH和Na2CO3过量,能与盐酸反应,所以离子方程式为:H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①反应Ⅱ是电解熔融氯化镁,化学方程式为:MgCl2
| ||
②反应Ⅲ为电解饱和食盐水,离子方程式为:2Cl-+2H2O
| ||
故答案为:(1)④③①②或③④①②或④①③②
(2)H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①MgCl2
| ||
②2Cl-+2H2O
| ||
点评:化学来源于生产、生活,又服务于生产、生活,本题主要考查氯化钠与粗盐提纯的步骤及注意事项以及化学方程式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目