题目内容
 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.
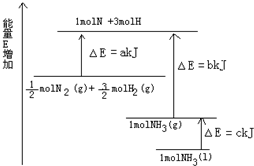
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是:
(2)已知:
①H2O(g)═H2O(l)△H=-Q1 kJ?mol-1
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q2 kJ?mol-1
③C2H5OH(g)═C2H5OH(l)△H=-Q3 kJ?mol-1
则23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)根据反应热等于旧键断裂吸收的能量减去新键形成所放出的能量计算反应热并书写热化学方程式,同时注意反应物的物质的量和生成物的聚集状态;
(2)利用盖斯定律,求出液态酒精燃烧生成二氧化碳和液态水的热化学方程式,即可解答.
(2)利用盖斯定律,求出液态酒精燃烧生成二氧化碳和液态水的热化学方程式,即可解答.
解答:
解:(1)解:由图可以看出,断裂
molN2(g)和
molH2(g)的吸收能量为akJ,形成1molNH3(g)的所放出的能量为bkJ,
所以,
molN2(g)+
molH2(g)?NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:
molN2(g)+
molH2(g)?NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(2)已知:
①H2O(g)═H2O(l)△H=-Q1 kJ?mol-1
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q2 kJ?mol-1
③C2H5OH(g)═C2H5OH(l)△H=-Q3 kJ?mol-1
据盖斯定律,②+3×①-③得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(Q2+3Q1-Q3)KJ/mol,即1mol酒精完全燃烧放热(Q2+3Q1-Q3)KJ,则23g酒精为0.5mol完全燃烧放热为:(0.5Q2+1.5Q1-0.5Q3)KJ,故答案为:(0.5Q2+1.5Q1-0.5Q3).
| 1 |
| 2 |
| 1 |
| 2 |
所以,
| 1 |
| 2 |
| 3 |
| 2 |
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:
| 1 |
| 2 |
| 3 |
| 2 |
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(2)已知:
①H2O(g)═H2O(l)△H=-Q1 kJ?mol-1
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q2 kJ?mol-1
③C2H5OH(g)═C2H5OH(l)△H=-Q3 kJ?mol-1
据盖斯定律,②+3×①-③得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(Q2+3Q1-Q3)KJ/mol,即1mol酒精完全燃烧放热(Q2+3Q1-Q3)KJ,则23g酒精为0.5mol完全燃烧放热为:(0.5Q2+1.5Q1-0.5Q3)KJ,故答案为:(0.5Q2+1.5Q1-0.5Q3).
点评:本题考查了据图象书写热化学方程式的方法以及盖斯定律的应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g)═2Z(g),并达到平衡.已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
| A、若X的反应速率为0.2 mol?L-1?s-1,则Z的反应速率为0.3 mol?L-1?s-1 |
| B、若向容器中充入氦气,压强增大,Y的转化率提高 |
| C、升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D、开始充入容器中的X、Y物质的量之比为2:1 |
下列说法不正确的是( )
| A、苯和浓硫酸在70~80℃时发生磺化反应 | ||
| B、芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质 | ||
| C、甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应 | ||
D、等质量的烃(CXHY)耗氧量取决于
|
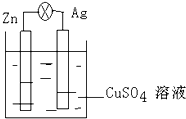 如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为
如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为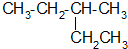 的系统命名为
的系统命名为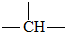 和一个-F,符合此要求的可能结构有
和一个-F,符合此要求的可能结构有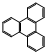 的一氯取代物有
的一氯取代物有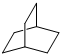 的二氯取代物有
的二氯取代物有