题目内容
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
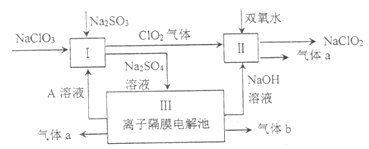
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
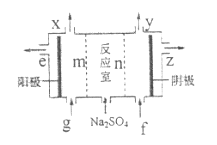
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
【答案】 ![]()
![]()
![]() e 阴 阴极反应为
e 阴 阴极反应为![]() ,反应室中的
,反应室中的![]() 透过阳离子交换膜进入阴极室,和阴极区产生的
透过阳离子交换膜进入阴极室,和阴极区产生的![]() 生成
生成![]() 1:4
1:4 ![]() 的氧化性或
的氧化性或![]() 的还原性随溶液的酸性和浓度的增大而增强,因此
的还原性随溶液的酸性和浓度的增大而增强,因此![]() 被氧化得到
被氧化得到![]() =
=
【解析】(1)由图得到I中将亚硫酸钠转化为硫酸钠,S的化合价由+4+升高为+6,所以还原剂为亚硫酸钠。
(2)II中进入的ClO2转化为NaClO2化合价降低,所以是H2O2中的O化合价升高为O2,方程式为: ![]() 。
。
(3)III中离子隔膜电解池,中间加入硫酸钠溶液,其中阴离子硫酸根离子向阳极移动,所以m是阳离子交换膜。阳极发生的反应为![]() ,氢离子浓度增加,结合穿过m的硫酸根离子得到硫酸,即X为氧气,e为硫酸,加入的g为稀硫酸(主要是为了溶液使导电)。对应的,n为阳离子交换膜,以保证钠离子能向阴极移动,阴极反应为
,氢离子浓度增加,结合穿过m的硫酸根离子得到硫酸,即X为氧气,e为硫酸,加入的g为稀硫酸(主要是为了溶液使导电)。对应的,n为阳离子交换膜,以保证钠离子能向阴极移动,阴极反应为![]() ,生成的氢氧根结合钠离子得到氢氧化钠,所以y为氢气,z为氢氧化钠溶液,加入的f为稀氢氧化钠(主要为了使溶液导电)。结合如上信息得到:
,生成的氢氧根结合钠离子得到氢氧化钠,所以y为氢气,z为氢氧化钠溶液,加入的f为稀氢氧化钠(主要为了使溶液导电)。结合如上信息得到:
①A的化学式是H2SO4,A在e口产生。
②m为阴离子交换膜。
③![]() 产生的原因如上所述。
产生的原因如上所述。
(4)①根据相同元素的相同价态一定直接转化的原理,生成物中的NaCl一定来自反应物的盐酸,NaCl有5个,HCl只有4个,所以有1个NaCl来自NaClO2,另外4个NaClO2转化为ClO2,所以氧化剂为1个NaClO2,还原剂为4个NaClO2,所以该反应中氧化剂和还原剂的物质的量之比是1:4。
②若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,说明使用浓盐酸时,会被NaClO2氧化为Cl2,即随着盐酸浓度增大,NaClO2的氧化性增强,或者盐酸的还原性增强。
的含量越大,说明使用浓盐酸时,会被NaClO2氧化为Cl2,即随着盐酸浓度增大,NaClO2的氧化性增强,或者盐酸的还原性增强。
(5)无论![]() 是否变质,最后氧化亚铁离子的时候,都是将亚铁离子氧化为铁离子,Cl最终都是转化为Cl-,变质的反应为3NaClO2 = 2NaClO3 + NaCl,则3molNaClO2转化为2molNaClO3,这2mol NaClO3得电子为2×6e-=12mol电子。如果不变质,3mol NaClO2得电子为3×4e-=12mol电子,所以NaClO2变质前后能得到的电子实际是一样的,能氧化的亚铁离子使相同的。
是否变质,最后氧化亚铁离子的时候,都是将亚铁离子氧化为铁离子,Cl最终都是转化为Cl-,变质的反应为3NaClO2 = 2NaClO3 + NaCl,则3molNaClO2转化为2molNaClO3,这2mol NaClO3得电子为2×6e-=12mol电子。如果不变质,3mol NaClO2得电子为3×4e-=12mol电子,所以NaClO2变质前后能得到的电子实际是一样的,能氧化的亚铁离子使相同的。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案