��Ŀ����
����Ŀ�����⻯�ƣ�NaAlH4�����л��ϳɵ���Ҫ��ԭ����ij�����龭�������Ϻ���ƺϳ����⻯�Ƶ�������ͼ��ʾ��

��֪����AlCl3��NaH��NaAlH4��ˮ����Ѹ�ٷ�����Ӧ��
�ڳ����£����ø�����ء�����ء��ظ���ء�������Ƶ���Ũ���ᷴӦ��ȡ������
��1�����⻯����ˮ�������ҷ�Ӧ���������ܷ�����ը����ԭ����_______
д�����⻯����ˮ��Ӧ�Ļ�ѧ����ʽ_________
��2����ͬѧ���ʵ���Ʊ���ˮ�Ȼ�����װ����ͼ��ʾ��
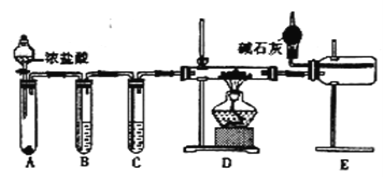
��װ��E�и���ܵ�������_______________________��
�ڵ�ȼװ��D���ƾ���֮ǰ �����ž�װ���ڵĿ����������������______��
��3����ͬѧ������ͬѧ��Ƶ�װ�ú���Ϊֻ�ı�A��B��D�е��Լ��Ϳ����ü�ͬѧ��Ƶ�װ���Ʊ�NaH��
���Թ�B�е��Լ���Ϊ____________________��
�����������������Ƶõ�NaH��Ʒ�п��ܺ��е�������_______��
��4����ͬѧ�������3��װ�òⶨ���⻯����Ʒ�Ĵ���(�������ʲ����뷴Ӧ)��

���ײ����ԡ�ȷ�ԽǶȿ�����ѡװ��___������ж����⻯����ˮ��ȫ��Ӧ��___
���𰸡� ��Ӧ�ų���������ʹ���ɵ�H2Ѹ�����Ͷ���ը NaAlH4+2H2O=NaAlO2+4H2�� ����ʣ�����������������е�ˮ��������D�� �Ƚ�װ��A�еķ�Һ©������Ӧһ��ʱ�䣬ʹD�в����ܳ�������ɫ���� NaOH��Һ Na2O2����Na�� �� �������ζ�ȡ��H2������
����������1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ��������䷴Ӧ�Ļ�ѧ����ʽΪNaAlH4+2H2O��NaAlO2+4H2������Ӧ�ų���������ʹ���ɵ�H2Ѹ�����Ͷ���ը����2����������Ⱦ������ͬʱ���Ȼ�������ˮ��Ӧ��֪��Eװ���еļ�ʯ������ʣ�����������������е�ˮ��������D�У��ڵ�ȼװ��D���ƾ���֮ǰ���Ƚ�װ��A�еķ�Һ©������Ӧһ��ʱ�䣬ʹD�в����ܳ�������ɫ�壬�ž�װ���ڵĿ�������3���ٽ����ƺ�����֮�仯�Ͽ��Ե�NaH��A���ɽ����������Ʊ����������ɵ��������Ȼ���Ӧ�ü����Լ���ȥ�����������ƣ���B���Լ�ΪNaOH��Һ���ڽ����ƺ����������»�����������������Լ�������Na����4���ɷ�Ӧԭ���ã��ⶨ���⻯����Ʒ�Ĵ��ȼ�ͨ���ⶨ���⻯����ˮ��Ӧ���ɵ����������������⻯�Ƶ������Ӷ������䴿�ȣ����ԴӼ�Լ�ԡ�ȷ�Կ��ǣ�װ�ü�û��ʹ�ú�ѹ©�����������������C��D������ˮ���ռ����������ڵ����л��в��������²���������������˵ķ������ң�ͨ���������ζ��������������ȣ�˵�����⻯����ˮ��ȫ��Ӧ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�