题目内容
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是___________________________;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
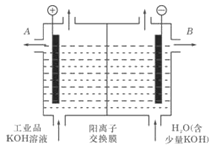
①该电解槽的阳极反应式是________________________;
②除去杂质后的氢氧化钾溶液从液体出口__________(填写“A”或“B”)导出。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
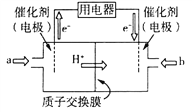
①通入气体a的电极是电池的________(填“正”或“负”)极,其电极反应式为___________________________________;
②当电池中有2 mol e-发生转移时,左右两侧溶液的质量差值为_________g。
【答案】 2Al2O3(熔融) ![]() 4Al + 3O2 4OH- — 4e- = 2H2O + O2 B 负 CH3OH — 6e- +H2O =CO2 + 6H+ 24
4Al + 3O2 4OH- — 4e- = 2H2O + O2 B 负 CH3OH — 6e- +H2O =CO2 + 6H+ 24
【解析】(1)工业冶炼铝的化学方程式是2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(2)①该电解槽的阳极反应式是4OH--4e-=2H2O+O2↑;
②阳离子向阴极移动,B为除去杂质的KOH,则除去杂质后的氢氧化钾溶液从液体出口B导出,故答案为:B;
(3)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O;
②负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移2mol电子时,左侧质量减轻![]() ×2×(44-32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×
×2×(44-32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×![]() ×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g。
×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g。

【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①平衡时,甲容器中CO的转化率是____________。比较下列容器中CO的转化率:乙________甲;丙________甲(填“>”、“=”或“<”)。
②丙容器中,通过改变温度,使CO的平衡转化率增大,则温度____________(填“升高”或“降低”),平衡常数K__________(填“增大”、“减小”或“不变”)。