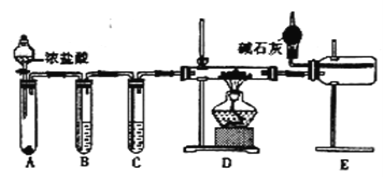
题目内容
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
【答案】D
【解析】A、某溫度时的混合溶液中C(H+) =![]() mol·L-1,而KW= c(H+) c(OH-),说明c(H+)= c(OH-),则溶液一定为中性,选项A正确;B、常温下,KW= c(H+) c(OH-)=10-14,纯水中c(H+)=c(OH-)=10-7,某溶液中,由水电离出的c(H+)=10-12mol·L-1<10-7 mol·L-1,说明溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶液可能是酸或碱或强酸的酸式盐,如果为酸溶液,则PH=2,如果为碱溶液,则pH=12,选项B正确;C、已知Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12,析出沉淀时,AgCl溶液中c(Ag+)=
mol·L-1,而KW= c(H+) c(OH-),说明c(H+)= c(OH-),则溶液一定为中性,选项A正确;B、常温下,KW= c(H+) c(OH-)=10-14,纯水中c(H+)=c(OH-)=10-7,某溶液中,由水电离出的c(H+)=10-12mol·L-1<10-7 mol·L-1,说明溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶液可能是酸或碱或强酸的酸式盐,如果为酸溶液,则PH=2,如果为碱溶液,则pH=12,选项B正确;C、已知Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12,析出沉淀时,AgCl溶液中c(Ag+)=![]() =
=![]() =1.56×10-8mol/L,Ag2CrO4溶液中:c(Ag+)=
=1.56×10-8mol/L,Ag2CrO4溶液中:c(Ag+)=![]() =
=![]() mol/L=3×10-5mol/L>1.56×10-8mol/L,Cl-先产生沉淀,选项C正确;D、常温下PH=7的CH3COOH和CH3COONa混合溶液呈中性,则c(H+)= c(OH-),结合电荷守恒可知:c(Na+)= c(CH3COO-),选项D不正确。答案选D。
mol/L=3×10-5mol/L>1.56×10-8mol/L,Cl-先产生沉淀,选项C正确;D、常温下PH=7的CH3COOH和CH3COONa混合溶液呈中性,则c(H+)= c(OH-),结合电荷守恒可知:c(Na+)= c(CH3COO-),选项D不正确。答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①平衡时,甲容器中CO的转化率是____________。比较下列容器中CO的转化率:乙________甲;丙________甲(填“>”、“=”或“<”)。
②丙容器中,通过改变温度,使CO的平衡转化率增大,则温度____________(填“升高”或“降低”),平衡常数K__________(填“增大”、“减小”或“不变”)。