题目内容
9.下列X溶液均能跟盐酸反应,其中反应速率最快的是( )| A. | 10℃时20mL、3mol•L-1的X溶液 | B. | 20℃时30mL、2mol•L-1的X溶液 | ||
| C. | 10℃时40mL、2mol•L-1的X溶液 | D. | 20℃时10mL、4mol•L-1的X溶液 |
分析 温度越高,反应速率越大,溶液浓度越大反应速率越大,据此分析判断反应速率大小.
解答 解:温度越高,反应速率越大,溶液浓度越大反应速率越大,BD选项温度大于AC,则BD反应速率大于AC;
B中X浓度小于D中浓度,则D中反应速率最快,故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、浓度对化学反应速率影响原理是解本题关键,采用比较法分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.已知下列元素的原子半径如表所示,根据以下数据,磷原子半径可能是( )
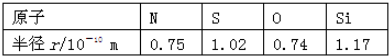

| A. | 0.70×10-10m | B. | 0.80×10-10m | C. | 1.10×10-10m | D. | 1.20×10-10m |
4.下列物质在固体状态时,所有原子的最外层都满足8电子结构且属于分子晶体的是( )
| A. | NH4Cl | B. | H2O | C. | SiO2 | D. | PCl3 |
14.下列变化或应用中,与分子间作用力有关的是( )
| A. | 臭氧转变为氧气 | |
| B. | 工业生产中氯化钠晶体的熔化、冷却 | |
| C. | 夏天马路洒水降温 | |
| D. | 日本大地震中用次氯酸溶液进行环境消毒 |
1.下列方法能使电离平衡H2O?H++OH-向左移动的是( )
| A. | 向水中加入少量氢氧化钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量碳酸钠固体 | D. | 将水加热到100℃,使水的pH=6 |
18.把aL含硫酸铵和硝酸铵的混合溶液分成两等份,一份需用bmol烧碱刚好把氨气全部赶出,另一份与氯化钡反应时,消耗BaCl2cmol,则原溶液中NO3-的物质的量浓度是( )
| A. | $\frac{(b-2c)}{a}$mol/L | B. | $\frac{(2b-c)}{a}$ mol/L | C. | $\frac{(2b-2c)}{a}$ mol/L | D. | $\frac{(2b-4c)}{a}$ mol/L |
19.某化学反应2A(g)?B(g)+D(g) 在3种不同条件下进行(均未使用催化剂),B和D的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表,下列叙述正确的是( )
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.92 | 0.75 | 0.63 | 0.60 | C1 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 实验1中,当反应进行到40min以后,反应停止了 | |
| B. | 实验2中,c1=0.60mol•L-1c2=1.2 mol•L-1 | |
| C. | 10-20min反应的速率:实验3>实验2>实验1 | |
| D. | 达平衡时A的转化率:实验3<实验1 |
 A、B、C、D、E五种周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
A、B、C、D、E五种周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物.请回答下列问题: