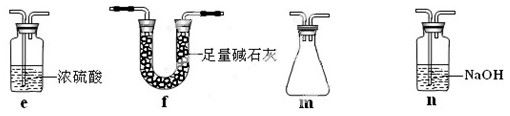
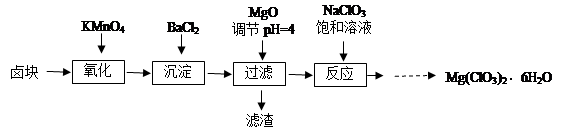题目内容
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
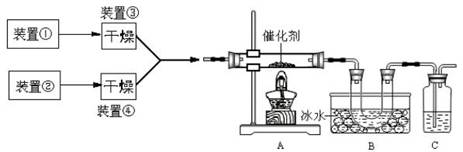
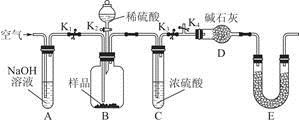
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是
装置①的作用是
(2)装置②中产生ClO2的还原剂是
装置④中制备ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
(1)防止倒吸(2分);吸收装置中末反应的ClO2,防止外逸污染空气(2分)
(2)Na2SO3(2分);2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(3分)
(3)用38℃~60℃的温水洗涤(2分)
(4)滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色(2分)
(5)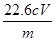 %(3分)
%(3分)
(6)4I―+O2+4H+ =2I2+2H2O(2分)
解析试题分析:(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;装置中有未反应的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;
答案为:防止倒吸;吸收未反应的ClO2,防止逸出污染空气;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
答案为:Na2SO3;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2·3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
答案为:用38℃~60℃热水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c mol·L-1×V×10-3L×
所以90.5g:mag=4mol:c mol·L-1×V×10-3L×
解得a= %,
%,
答案为: %
%
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
答案为:4I-+O2+4H+=2I2+2H2O.
考点:氯、溴、碘及其化合物的综合应用;探究物质的组成或测量物质的含量;制备实验方案的设计

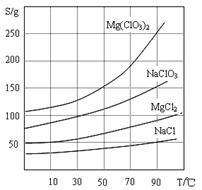
下表是四种盐在不同温度下的溶解度(g/100g水):
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
用于提纯或分离物质的方法有:
| A.萃取分液; | B.加热分解; | C.蒸发结晶; | D.分液;E、蒸馏;F、过滤等,请将提纯或分离方法的序号填在后面横线上。 |
(2)分离水和汽油的混合物___
(3)分离相溶的CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |
(3)步骤3如何实现?两位同学设计下列方案:
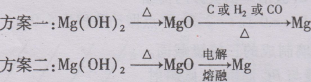
这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。