题目内容
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |
(3)步骤3如何实现?两位同学设计下列方案:

这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。
(15分)(1)取海水晒盐后的苦卤水作原料(其它合理答案给分,2分)
(2)Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+(2分); ×10-6mol/L(2分,回答1.36×10-6mol/L也可);Ca(OH)2(1分);以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳(2分)
×10-6mol/L(2分,回答1.36×10-6mol/L也可);Ca(OH)2(1分);以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳(2分)
(3)方案一:不合理,H2、C或CO均不能还原MgO(2分)
方案二:不合理,MgO熔点高,能耗大,不经济(2分)
合理方案: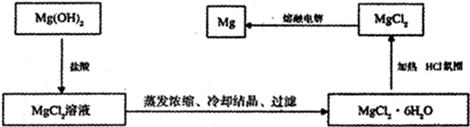 (2分)
(2分)
解析试题分析:(1)海水Mg2+中浓度很小,因此提高海水中Mg2+浓度的方法是取海水晒盐后的苦卤水作原料。
(2)步骤2的目的是将Mg2+转化为氢氧化镁沉淀,所以有关反应的离子方程式为Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+;根据氢氧化镁的溶度积常数可知,浓缩海水中MgCI2浓度为3mo1/L,要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 =
= ×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。
×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。
(3)由于H2、C或CO均不能还原MgO所以方案一不合理;又因为MgO熔点高,能耗大,不经济,因此方案二也不合理;正确的方案应该是将氢氧化镁转化为氯化镁,然后电解熔融的氯化镁即可。流程图如下: 。
。
考点:考查海水中镁提纯的有关实验设计、分析、判断以及评价;溶度积常数的有关计算等

选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(2)__ _从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)__ _分离水和汽油的混合物。
(4)__ _分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A + B | 无明显现象 |
| ② | B + D | 有无色无味气体放出 |
| ③ | C + B | 有白色沉淀生成 |
| ④ | A + D | 有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)
A B C D
(2)写出B与D反应的离子方程式
写出B与C反应的离子方程式
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |


请回答下列问题:
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol?L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2?H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下: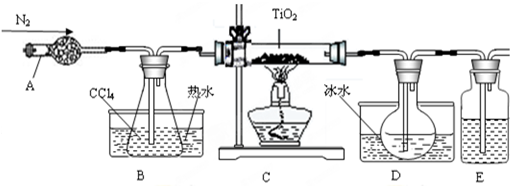
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l)
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)简要工艺流程如下:

①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。



