题目内容
下列溶液中各微粒的浓度关系一定正确的是( )
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在: 、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH, pH的大小顺序是:④>③>①>② |
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO )+c(OH-)+c(CO )+c(OH-)+c(CO ) ) |
| D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1 |
B
试题分析:A不正确,也可能存在c(Cl-) >c(H+) >c(NH
 )>c(OH-);酸性越弱,相应的钠盐越容易水解,溶液的碱性就越强。由于氢氧化钠是强碱,碱性最强,所以选项B正确;C不正确,不符合电荷守恒,应该是c(Na+)+c(H+)=c(HCO
)>c(OH-);酸性越弱,相应的钠盐越容易水解,溶液的碱性就越强。由于氢氧化钠是强碱,碱性最强,所以选项B正确;C不正确,不符合电荷守恒,应该是c(Na+)+c(H+)=c(HCO )+c(OH-)+2c(CO
)+c(OH-)+2c(CO );D中醋酸钠促进水的电离,氨水抑制水的电离,所以由水电离出的c(OH-)之比为106∶1,D不正确,答案选B。
);D中醋酸钠促进水的电离,氨水抑制水的电离,所以由水电离出的c(OH-)之比为106∶1,D不正确,答案选B。点评:该题综合性强,对学生的思维能力提出了更高的要求,不易得分。该题的关键是利用好电荷守恒、物料守恒以及质子守恒,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目

 H++OH-向右移动,且使溶液呈酸性的是( )
H++OH-向右移动,且使溶液呈酸性的是( ) ══
══

 ══
══

 ══
══
 ══
══
 mol/L
mol/L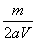 mol/L
mol/L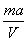 mol/L
mol/L mol/L
mol/L