题目内容
将质量分数为a%的NaOH溶液蒸发掉m g水后,变成VmL2a%NaOH不饱和溶液,则蒸发后溶液的
物质的量浓度是( )
物质的量浓度是( )
A.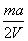 mol/L mol/L | B.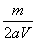 mol/L mol/L | C.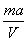 mol/L mol/L | D. mol/L mol/L |
A
试题分析:设蒸发后溶液的物质的量浓度为x,溶液的质量为t,则NaOH的物质的量为0.01Vx,NaOH的质量为0.01Vx×40,根据蒸发前后NaOH质量不变的关系,有以下关系:
(0.01Vx×40)/t=2a%
(0.01Vx×40)/(t+m)=a% 则t=m
由(0.01Vx×40)/m="2a%" 求得x=(ma/2V)mol/L
点评:此题根据蒸发前后溶质的质量不变的关系计算物质的量浓度,理清关系后,难度不大。

练习册系列答案
相关题目
 CO32—+H3O+
CO32—+H3O+ 、Cl-、H+、OH-四种离子,溶液中一定存在:
、Cl-、H+、OH-四种离子,溶液中一定存在: )+c(OH-)+c(CO
)+c(OH-)+c(CO )
)
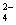 )+ c(HC2O
)+ c(HC2O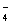 )
)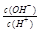 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是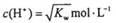 (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)