题目内容
o键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的o键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
- A.H2
- B.HCl
- C.Cl2
- D.F2
B
A中氢气全部是s轨道以“头碰头”方式重叠构建而成的是。氯气和单质氟全部是p轨道以“头碰头”方式重叠构建而成的是。氯化氢中氢原子提供s轨道电子,氯原子提供p轨道电子,所以选项B正确,答案选B。
A中氢气全部是s轨道以“头碰头”方式重叠构建而成的是。氯气和单质氟全部是p轨道以“头碰头”方式重叠构建而成的是。氯化氢中氢原子提供s轨道电子,氯原子提供p轨道电子,所以选项B正确,答案选B。

练习册系列答案
相关题目
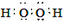
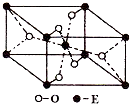 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.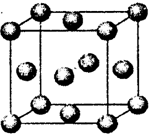 (2011?丹东模拟) 化学一一选修物质结构与性质
(2011?丹东模拟) 化学一一选修物质结构与性质