题目内容
【题目】合成氨对工、农业生产和国防都有重要意义。 已知:N2(g)+3 H2(g)2NH3(g) △H= -92.4kJ/mol,请回答:
(1)合成氨工业中采取的下列措施可以用平衡移动原理解释的是________(填字母)。
a. 用铁触媒加快化学反应速率
b. 采用较高压强(20MPa~50MPa)
c. 采用较高温度(500℃左右)
d. 将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1mol N2和3mol H2并发生反应。
①若容器容积恒定,达到平衡时,N2的转化率α1 =25%,此时,反应放热______kJ,容器内气体压强与开始时气体压强之比是________。
②若容器压强恒定,则达到平衡时,容器中N2的转化率α2______α1(填“>”“<”或“=”)。
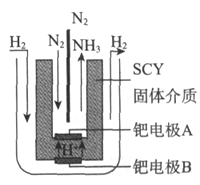
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递![]() )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
【答案】bd23.17:8>阴![]()
【解析】
(1)a.用铁作催化剂加快化学反应速率,催化剂不能使平衡移动,使用催化剂是为了加快化学反应速率,用勒夏特列原理无法解释;b.采用较高压强(20Mpa-50MPa),合成氨是气体体积减小的反应,加压至20~50MPa,有利于化学平衡正向移动,有利于氨的合成,可用勒夏特列原理解释;c.加热到500℃合成氨是放热反应,升温会使平衡逆向移动,降低转化率,升温的目的是为了保证催化剂的催化活性,加快化学反应速率,不能用勒夏特列原理解释;d.将生成的氨液化并及时从体系中分离出来,将氨及时液化分离,利于化学平衡正向移动,有利于氨的合成,可用勒夏特列原理解释;故答案为:bd;
(2)①因N2的转化率为25%,放出的热量为:1mol×0.25×92.4kJ/mol=23.1KJ,在恒温恒容条件下,容器内气体压强与开始时气体压强之比等于气体的物质的量之比,平衡时容器中气体的物质的量为:4mol-1mol×0.25×2=3.5mol,则容器内气体压强与开始时气体压强之比为:3.5mol:4mol=7:8;故答案为:23.1、7:8;②在恒容条件下,可逆反应在建立平衡的过程中,容器中的气体分子数目减少,则容器内的压强减小,故在恒压条件下容器内的压强比恒容条件下大,由于该反应正反应是一个气体分子数目减小的反应,故在恒压条件下有利于反应的正向进行,氮气的转化率更大,故答案为:>;
(3)由图示可知钯电极A上氮气被还原为氨,发生还原反应,是电解池的阴极,发生的电极反应为:N2+6e-+6H+═2NH3,故答案为:阴;N2+6e-+6H+═2NH3。






