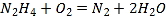题目内容
【题目】用结构和原理阐释化学反应的类型、限度、速率和历程是重要的化学学科思维。回答下列问题:
(1)用过氧化氢检验Cr(Ⅵ)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5结构式为![]() ,该反应是否为氧化还原反应?___(填“是”或“否”)。
,该反应是否为氧化还原反应?___(填“是”或“否”)。
(2)已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+O2(g)=H2O2(l) △H=-187.8kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) △H=___kJ·mol-1。
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。
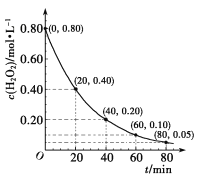
①0-20min内,v(H2O2)=___。
②据图分析,n=___。
③其它条件相同,使用活性更高的催化剂,下列说法正确的是___(填标号)。
A.v(H2O2)增大 B.k增大 C.△H减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时![]() =___,Kp2=___。
=___,Kp2=___。
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将___(填“增加”“减少”或“不变”,下同),NaHCO3质量将___。
【答案】否 -196 0.020mol/(Lmin) 1 AB 9 4(kPa)2 增加 减少
【解析】
(1)有化合价发生变化的反应为氧化还原反应,根据CrO5结构式为![]() 分析反应中是否有化合价变化;
分析反应中是否有化合价变化;
(2)根据盖斯定律解答;
(3)①0-20min内,根据图像,利用v=![]() 计算v(H2O2);
计算v(H2O2);
②已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),根据图示,每间隔20分钟,双氧水的浓度变为原来的一半,则速率也变为原来的二分之一;
③催化剂能加快反应速率,降低活化能,不能改变焓变;
(4)①利用相同条件下物质的量之比等于压强之比,结合![]() 求解;
求解;
②利用Qp与Kp的大小关系解答;
(1)由CrO5的结构式可知存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键中O为-2价,Cr元素化合价为+6价,反应前后元素化合价没有发生变化不是氧化还原反应;
(2) 已知:①2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ·mol-1
②H2(g)+O2(g)=H2O2(l) △H = -187.8kJ·mol-1
则根据盖斯定律,①-②×2可得,2H2O2(l)=2H2O(l)+ O2(g) △H = -196kJ·mol-1;
(3)①0-20min内,根据图像,H2O2的浓度变化量=0.4 mol/L,v(H2O2)=![]() =0.020mol/(Lmin);
=0.020mol/(Lmin);
②根据图示,每间隔20分钟,双氧水的浓度变为原来的一半,则速率也变为原来的二分之一,已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),20分钟时的双氧水瞬时速率v(H2O2)20min= k×(0.4)n,40分钟时的双氧水瞬时速率v(H2O2)40min= k×(0.2)n,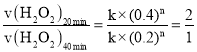 ,则(0.4)n=2×(0.2)n,则n=1;
,则(0.4)n=2×(0.2)n,则n=1;
③A.催化剂能加快反应速率,故v(H2O2)增大,故A正确;
B.催化剂能加快反应速率,则速率常数k增大,故B正确;
C.催化剂不改变反应热(焓变),则△H不变,故C错误;
D.催化剂可降低反应的活化能,则Ea(活化能)减小,故D错误;
答案选AB;
(4)①假设只发生以下反应,达平衡时两者分解的物质的量比为2:1,设发生分解的CuSO4·5H2O的物质的量为2mol,根据反应CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g),则生成水蒸气的物质的量为4mol,设发生分解2NaHCO3的物质的量为1mol,根据反应2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g),则生成的水蒸气和二氧化碳分别为0.5mol,利用相同条件下物质的量之比等于压强之比,![]() =
=![]() =9结合
=9结合![]() =9,则Kp2=
=9,则Kp2=![]() =
=![]() =4(kPa)2求解;
=4(kPa)2求解;
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。对于反应CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g),Qp1=(8kPa)2=64(kPa)2>Kp1,平衡逆向进行,容器内CuSO4·5H2O的质量将增加;对于反应2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g),Qp2= p(H2O) p(CO2)=3.2(kPa)2<Kp2,平衡正向进行,容器内NaHCO3质量将减小。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案