题目内容
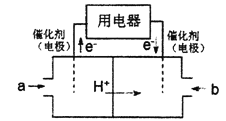
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol·L-1的H2SO4溶液中,乙同学将两电极放入6mol·L-1的NaOH溶液中,装置如图所示。
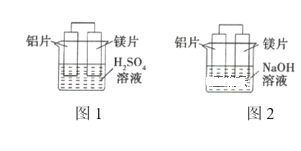
(1)写出图1中正极的电极反应式:_______________ 。
(2)图2中负极为_______________,总反应的离子方程式为____________。
(3)由该实验得出的下列结论中,正确的有 _______________(填序号)。
a.利用原电池反应判断金属活动性强弱时应注意原电池中的电解质溶液
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
【答案】2H++2e-=H2↑ 铝片 2Al+2OH-+2H2O=2AlO2-+3H2↑ ad
【解析】
甲同学依据的化学反应原理是Mg+H2SO4=MsSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由于Al与强碱的反应是一个特例,因此不能作为判断金属活动性强弱的依据,据此分析解答。
(1)①中镁易失电子作负极、Al作正极,负极上镁失电子发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)②中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,故答案为:铝片;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)a.根据甲、乙中电极反应式知,原电池的正负极与电解质溶液有关,故a正确;b.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故b错误;c.该实验说明电解质溶液的性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故c错误;d.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同会导致反应的产物不同,所以应具体问题具体分析,故d正确;故答案为:ad。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案