题目内容
17.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 常温下0.1mol•L-1的下列溶液中:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4mol•L-1CH3COOH溶液和0.2mol•L-1NaOH溶液等体积混合后溶液显酸性,溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1 Na2CO3溶液与0.2mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol•L-1H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)═2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
分析 A.铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则相同浓度的铵盐溶液中铵根离子浓度越小;
B.反应后的溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合物料守恒、电荷守恒判断;
C.根据混合液中的物料守恒、电荷守恒进行判断;
D.二者恰好反应生成草酸铵,根据草酸铵溶液的物料守恒判断.
解答 解:A.铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则相同浓度的铵盐溶液中铵根离子浓度越小,所以相同浓度的这三种盐,c(NH4+) 由大到小的顺序是①>②>③,故A错误;
B.常温下0.4mol•L-1CH3COOH溶液和0.2mol•L-1NaOH溶液等体积混合后溶液显酸性,反应后质为等浓度的醋酸和醋酸钠,溶液显示酸性说明醋酸的电离程度大于醋酸根离子的水解程度,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+);根据物料守恒2c(Na+)=c(CH3COO-)+c(CH3COOH)可知,c(CH3COO-)>c(Na+)>c(CH3COOH),则溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C.根据电荷守恒可得:①2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据电荷守恒可得:②3c(Na+)=4c(CO32-)+4c(H2CO3)+4c(HCO3-),根据①②可得:2c(CO32-)+3c(OH-)=c(HCO3-)+4c(H2CO3)+3c(H+),故C错误;
D.01mol•L-1的氨水与0.05mol•L-1H2C2O4溶液等体积混合后恰好反应生成草酸铵,根据混合液中的物料守恒可得:c(NH4+)+c(NH3•H2O)═2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CH3COOH | B. | H2SO4 | C. | H2S | D. | Na2SO4 |
| A. | 向澄清石灰水中滴入少量的NaHCO3溶液:HCO3?+OH?+Ca2+═CaCO3↓+H2O | |
| B. | 用CH3COOH除水垢:CaCO3+2H+=H2O+CO2↑+Ca2+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O+Ca2+═CaSO4↓+2HClO | |
| D. | 少量的氯气通入溴化亚铁溶液中:Cl2+2Br-═Br2+2Cl- |
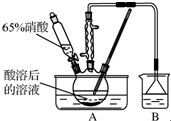 已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.
已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O. 水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.