题目内容
19.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16g CH4所含原子数目为NA | |
| C. | 1mol氦气中有2NA个氦原子 | |
| D. | 2L 0.3mol•L-1 Na2SO4溶液中含1.2NA个Na+ |
分析 A.质量转化为物质的量,结合1mol镁中含有12mol电子;
B.甲烷分子中含有4个原子,16g甲烷的物质的量为1mol,含有4mol原子;
C.氦气为单原子分子;
D.依据n=CV计算硫酸钠的物质的量,结合1mol硫酸钠含有2mol钠离子解答.
解答 解:A.2.4g镁的物质的量为0.1mol,0.1mol镁中含有1.2mol电子,故A错误;
B.16g甲烷的物质的量为1mol,1mol甲烷中含有4mol原子,所含原子数目为4NA,故B错误;
C.氦气为单原子分子,1mol氦气中有NA个氦原子,故C错误;
D.2L 0.3mol•L-1 Na2SO4溶液含有硫酸钠的物质的量为0.6mol,含有钠离子的物质的量为1.2mol,含1.2NA个Na+,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,题目难度不大.

练习册系列答案
相关题目
7.下列常用干燥剂,不能干燥氯气的是( )
| A. | 浓硫酸 | B. | 五氧二磷 | C. | 碱石灰 | D. | 氯化钙 |
14.(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出(填吸收或放出)热量,△H小于(填大于或小于)0;
(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
11.下列说法错误的是( )
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
16.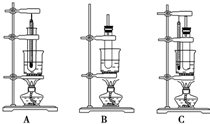 现有三种实验装置,如图,要制备硝基苯,应选用( )
现有三种实验装置,如图,要制备硝基苯,应选用( )
 现有三种实验装置,如图,要制备硝基苯,应选用( )
现有三种实验装置,如图,要制备硝基苯,应选用( )| A. | 装置A | B. | 装置B | C. | 装置C | D. | 都不行 |
17.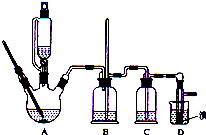 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如表:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4.
有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4.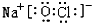 .
.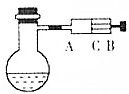 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白: