题目内容
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: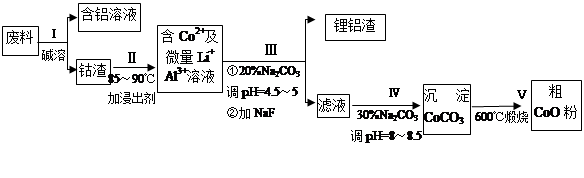
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
(共14分)
(1)2Al+2OH-+2H2O = 2AlO- 2+3H2↑
(2)4Co2O3·CoO + Na2S2O3 + 11H2SO4 = 12CoSO4 + Na2SO4 + 11H2O
Co2O3·CoO可氧化盐酸产生Cl2,污染环境。(合理即可)
(3)2Al3++3CO2- 3+3H2O = 2Al(OH)3↓+3CO2↑
(4)调整pH,提供CO2- 3,使Co2+沉淀为CoCO3
(5)B C D (有错不得分,答对2个得1分,全对得2分)
(6)CoCl2?2H2O
解析试题分析:
(1)铝和氢氧化钠溶液反应:2Al+2OH-+2H2O = 2AlO2-+3H2↑
(2)①酸根应为硫酸根,根据溶液中离子可得方程式:4Co2O3·CoO + Na2S2O3 + 11H2SO4 = 12CoSO4 + Na2SO4 + 11H2O;盐酸中氯具有一定还原性,Co2O3·CoO可氧化盐酸产生Cl2,污染环境。
(3)发生双水解:2Al3++3 CO2- 3+3H2O = 2Al(OH)3↓+3CO2↑。
(4)调整pH,提供CO2- 3,使Co2+沉淀为CoCO3
(5)CO2- 3会部分水解:CO2- 3+H2O HCO3-+OH–,HCO3-+H2O
HCO3-+OH–,HCO3-+H2O H2CO3+OH- A、 c(Na+) >2c(CO2- 3),错误;B 、c(Na+) > c(CO2- 3) > c(HCO3-),正确;C 、c(OH-) > c(HCO3-) > c(H+),正确;D、质子守恒: c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3),正确。
H2CO3+OH- A、 c(Na+) >2c(CO2- 3),错误;B 、c(Na+) > c(CO2- 3) > c(HCO3-),正确;C 、c(OH-) > c(HCO3-) > c(H+),正确;D、质子守恒: c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3),正确。
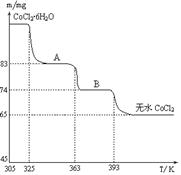
(6)最终无水的m(CoCl2)=65mg,M(CoCl2)=130g/mol,所以n(CoCl2)=0.5×10-3mol,从A到无水氯化钴减少m(H2O)="18mg," n(H2O)=1×10-3mol,可知N(CoCl2):N(H2O)=1:2,为CoCl2?2H2O。
考点:本题以工业流程为载体考查元素及其化合物性质、方程式书写、电解质溶液、化学计算等相关知识。。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表;
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
| V | V的单质是淡黄色固体,是黑火药的一种主要成分 |
| W | W的单质是人们最早发现和使用的金属之一 |
(1)X位于第___周期____族。
(2)写出Z2Y2与水反应的离子方程式 。
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体。请写出化学反应方程式 。
(4)已知:W2Y3(s)+3XY(g)=2W(s)+3XY2(g) △H=–26.7kJ·mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g) △H=–50.75 kJ·mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g) △H=–36.5 kJ·mol-1
则相同条件下,反应WY(s)+XY(g)=W(s)+XY2(g)的△H= 。
随着卤素原子半径的增大,下列递变规律正确的是
| A.单质的熔点逐渐降低 | B.卤素离子还原性逐渐增强 |
| C.气态氢化物稳定性逐渐增强 | D.单质氧化性逐渐增强 |
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是
| A.制半导体的材料 | B.耐高温、耐腐蚀的合金材料 |
| C.制农药的材料 | D.制催化剂的材料 |
考古学常用14C来确定文物的历史年代,14C原子核内中子数是
| A.6 | B.8 | C.14 | D.20 |
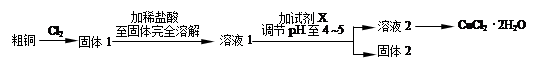

 CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l) 、
、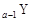 、
、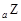 、
、 、
、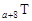 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。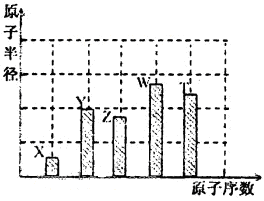
 和2mol D
和2mol D C
C