题目内容
 、
、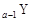 、
、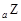 、
、 、
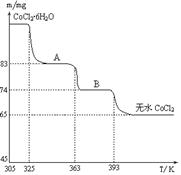
、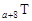 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。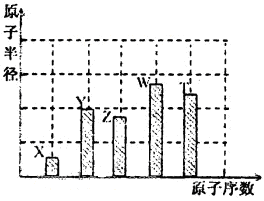
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
(1)第三周期第ⅣA族(2分)
(2)极性键(或共价键) H2O(2分)
(3)3NO2+H2O=2HNO3+NO(2分);取一小块试纸放在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测酸雨液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,记录pH(2分)
(4)OH-+SO2=HSO3-(2分);因为HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O H2SO3+OH-,HSO3-的电离程度大于它的水解程度(2分)
H2SO3+OH-,HSO3-的电离程度大于它的水解程度(2分)
(5)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=—1520kJ/mol(2分)
解析试题分析:Z是地壳中含量最高的元素,因此Z是氧元素。a=8,所以X、Y、T的原子序数分别是1、7、16,则分别是H、N和S元素。W原子最外层电子数是K层电子数的2倍,且W的原子半径最大,所以W是第三周期元素,因此W是Si元素。
(1)硅元素的原子序数是14,在周期表中的位置是第三周期第ⅣA族。
(2)Y、Z的10电子氢化物分子分别是NH3和H2O,其中均含有的化学键类型为极性键。非金属性越强,氢化物的稳定性越强。氧元素的非金属性强于氮元素的,因此氢化物稳定性强的是H2O。
(3)NO2溶于水生成硝酸和NO,从而形成硝酸型酸雨,反应的化学方程式为3NO2+H2O=2HNO3+NO;用pH试纸测量溶液pH值的实验操作是:取一小块试纸放在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测酸雨液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,记录pH。
(4)氢氧化钠的物质的量是1mol/L×0.1L=0.1mol,这说明与SO2的物质的量相等,因此反应中生成亚硫酸氢钠,所以反应的离子方程式为OH-+SO2=HSO3-。溶液中存在HSO3-的水解平衡和电离平衡,即HSO3-+H2O H2SO3+OH-、HSO3-
H2SO3+OH-、HSO3- SO32-+H+,由于HSO3-的电离程度大于它的水解程度,因此溶液显酸性,即pH<7。
SO32-+H+,由于HSO3-的电离程度大于它的水解程度,因此溶液显酸性,即pH<7。
(5)W与X形成的气态化合物是SiH4,在和氧气的反应中转移8个电子(从—4价升高到+4价),所以根据题意可知,每生成1mol二氧化硅反应放出的热量=190 kJ×8=1520kJ,则该反应的热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=—1520kJ/mol。
考点:考查元素周期表的结构以及元素周期律的应用;pH试纸使用、盐类水解和电离平衡以及热化学方程式的书写等

 导学全程练创优训练系列答案
导学全程练创优训练系列答案一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: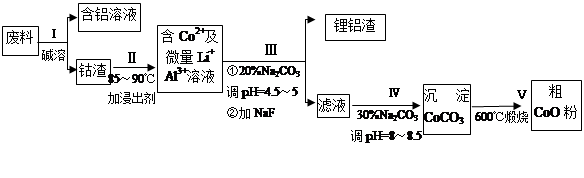
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
下列说法正确的是( )
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
关于元素周期表的说法正确的是( )
| A.元素周期表有8个主族 | B.元素周期表有7个周期 |
| C.短周期是指第一、二周期 | D.IA族的元素全部是金属元素 |
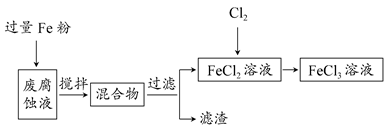

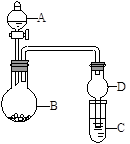
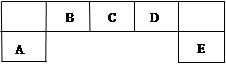
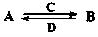 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。