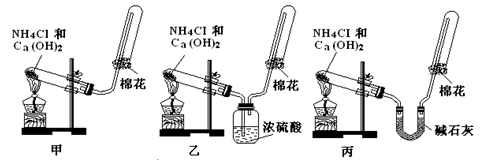
题目内容
(10分) 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)写出Fe2+的核外电子排布式
(2)用轨道表示式表示Fe3+的3d电子的排布情况
(3)硫酸亚铁制备中实验步骤①的目的是 。
(4)实验步骤②明显不合理,理由是 。
(5)实验步骤④中用少量冰水洗涤晶体,其目的是 。
(1)写出Fe2+的核外电子排布式
(2)用轨道表示式表示Fe3+的3d电子的排布情况
(3)硫酸亚铁制备中实验步骤①的目的是 。
(4)实验步骤②明显不合理,理由是 。
(5)实验步骤④中用少量冰水洗涤晶体,其目的是 。
(1)[Ar]3d6 (2) 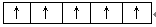 (3)除去铁屑上的油污
(3)除去铁屑上的油污
(4)Fe不能反应完全,余少部分防止Fe2+被氧化成Fe3+
(5) 洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗(2分×5)
 (3)除去铁屑上的油污
(3)除去铁屑上的油污 (4)Fe不能反应完全,余少部分防止Fe2+被氧化成Fe3+
(5) 洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗(2分×5)
(1)根据构造原理可写出Fe2+的核外电子排布式为[Ar]3d6。
(2)洪特规则电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是 。
。
(3)碳酸钠溶液显碱性,可以除去铁屑上的油污。
(4)亚铁离子易被氧化生成铁离子,所以必须让铁过量,防止Fe2+被氧化成Fe3+。
(5)晶体表面会吸附溶液中的稀硫酸,所以用水洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗。
(2)洪特规则电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是
 。
。(3)碳酸钠溶液显碱性,可以除去铁屑上的油污。
(4)亚铁离子易被氧化生成铁离子,所以必须让铁过量,防止Fe2+被氧化成Fe3+。
(5)晶体表面会吸附溶液中的稀硫酸,所以用水洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗。

练习册系列答案
相关题目
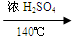 C2H4 ↑+ H2O
C2H4 ↑+ H2O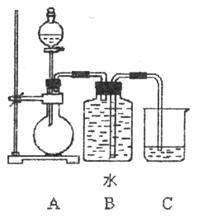
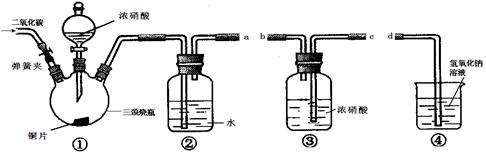
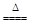 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O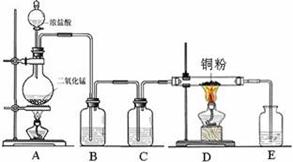
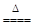 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。