题目内容
14.短周期元素R、Q、M、T在元素周期表中的相对位置如表,已知R原子最外层电子数与次外层电子数之比为2:1.| R | Q | ||
| M | T |
 ; 元素M在元素周期表中的位置是第三周期第VIA族.
; 元素M在元素周期表中的位置是第三周期第VIA族.(2)R的最高价氧化物所含的化学键类型是共价键(选填“离子”或“共价”).
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O(用具体的化学式表示).
(4)在一定条件下甲、乙、丙有如下转化:甲$\stackrel{+X}{→}$乙$→_{化合反应}^{+X}$丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是④(选填序号).
①R ②Q2 ③M ④T2
(5)元素T的含氧酸HTO具有漂白性写出HTO的电子式
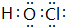 .
.
分析 由元素在短周期中位置,可知R、Q处于第二周期,M、T处于第三周期,R原子最外层电子数与次外层电子数之比为2:1,则最外层电子数为4,故R为C,可推知Q为N、M为S、T为Cl.
(1)Cl-离子核外电子数为18,有3个电子层,各层电子数为2、8、8;主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)R的最高价氧化物为CO2,属于共价化合物;
(3)碳与浓硝酸反应生成二氧化硫、二氧化氮与水;
(4)甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则X是氧气,甲能连续被氧化且为单质,甲可能是氮气、C、S等;
(5)HClO中O原子与H原子、Cl原子之间分别形成1对共用电子对.
解答 解:由元素在短周期中位置,可知R、Q处于第二周期,M、T处于第三周期,R原子最外层电子数与次外层电子数之比为2:1,则最外层电子数为4,故R为C,可推知Q为N、M为S、T为Cl.
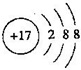
(1)T是Cl元素,Cl-离子质子数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8,氯离子结构示意图为 ;元素M是S元素,原子核外有3个电子层、最外层电子数为6,位于第三周期第VIA族,
;元素M是S元素,原子核外有3个电子层、最外层电子数为6,位于第三周期第VIA族,
故答案为: ;第三周期第VIA族;
;第三周期第VIA族;
(2)R的最高价氧化物是CO2,二氧化碳分子中C原子和O原子之间只存在共价键,故答案为:共价键;
(3)碳与浓硝酸反应生成二氧化硫、二氧化氮与水,反应方程式为4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;
(4)在一定条件下甲、乙、丙有如下转化:甲$\stackrel{+X}{→}$乙$→_{化合反应}^{+X}$丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则X是氧气,甲能连续被氧化且为单质,甲可能是氮气、C、S等,氯气不能被氧气氧化,故选:④;
(5)HClO中O原子与H原子、Cl原子之间分别形成1对共用电子对,电子式为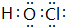 ,故答案为:
,故答案为: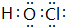 .
.
点评 本题考查原子结构与元素周期表应用,推断元素是解题关键,(5)中电子式书写为易错点,学生容易按化学式形式书写,忽略原子成键数目问题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①氘和氚是质量数不同、质子数相同的氢的两种元素
②氢元素是指1H
③1H、2H、3H是氢的三种同位素,是同一种元素的三种原子
④1H和2H的化学性质几乎完全相同
⑤H2、D2、T2的摩尔质量相等.
| A. | ②③ | B. | ③④ | C. | ①③④⑤ | D. | ②③④⑤ |
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
| A. | 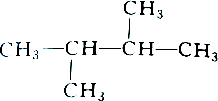 和 和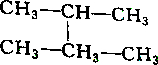 | B. | 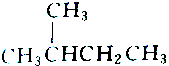 和 和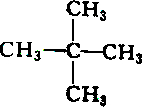 | ||
| C. | 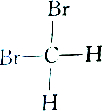 和 和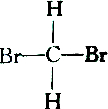 | D. | 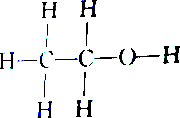 和 和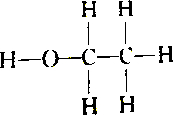 |
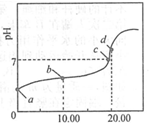 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )| A. | a点PH=2 | |
| B. | b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) | |
| C. | c点表示NaOH溶液与CH3COOH溶液恰好完全反应 | |
| D. | d点对用的溶液中,水的电离程度小于同温下纯水的电离程度 |
| A. | CO和N2 | B. | CO2和N2O | C. | CO32-和NO3- | D. | CO2和SO2 |
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
 .
.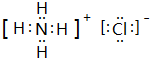 ,A2C2的电子式为
,A2C2的电子式为 .
.