题目内容
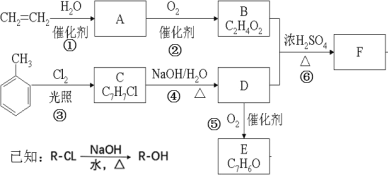
【题目】下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):

(1)物质I的化学式为________;F中阴离子是______________;
(2)反应①的化学方程式为为____________;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为____________;
(4)反应②的化学方程式为_____________;
(5)若E与G以物质的量比为1:1投入足量水中,反应的化学方程式为_________;生成1mol气体转移电子的个数为__________。
【答案】Fe(OH)3 Cl- 2H2O2![]() 2H2O+O2 MnO2+4H++2Cl-
2H2O+O2 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 3Fe + 4H2O(g)
Mn2++Cl2↑+2H2O 3Fe + 4H2O(g)![]() Fe3O4 +4H2 4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑ 6NA
Fe3O4 +4H2 4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑ 6NA
【解析】
丙为黄绿色单质气体,所以丙为Cl2,B与K的反应是实验室制取丙的反应,且B为黑色粉末,则B为MnO2,K为HCl;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C为H2O,丁为氧气;G为淡黄色固体,且可以生成氧气,则G应为Na2O2,则J为生活中常见的调味品,应为NaCl,I为红褐色固体应为Fe(OH)3;F为棕黄色溶液,应含Fe3+,E与氯气反应可生成F,则F为FeCl3,E为FeCl2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D为Fe3O4。
(1)根据分析可知物质I为Fe(OH)3;F中阴离子为Cl-;
(2)反应①为双氧水在二氧化锰的催化作用下制取氧气,方程式为2H2O2![]() 2H2O+O2;
2H2O+O2;
(3)实验室利用浓盐酸和二氧化锰共热制取氯气,方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)反应②为Fe在高温条件下与水蒸气反应生成氢气和四氧化三铁的反应,方程式为:3Fe + 4H2O(g)![]() Fe3O4 +4H2;
Fe3O4 +4H2;
(5)E为FeCl2,G为Na2O2,过氧化钠有强氧化性可氧化亚铁离子为铁离子,被还原时-1价的氧被还原成-2价,二者1:1反应,说明氧化产物不止有Fe3+,再联系过氧化钠可以与水反应生成氧气,可知产物中应还有氧气,Na2O2自身发生氧化还原反应,所以E与G以物质的量比为1:1投入足量水中,反应方程式为4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑。

【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。