题目内容
【题目】焦亚硫酸钠(Na2S2O5)可用作还原剂,印染媒染剂、食品防腐剂等。一种湿法制备焦亚酸钠的工艺流程如图。
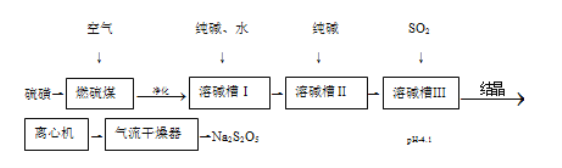
已知:过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺先加热成液态后喷人燃硫炉中,作用是__。
(2)“净化”需要除去的杂质气体是__。
(3)溶碱槽Ⅰ中需要通入足量SO2,若SO2不足,则生成__。
(4)溶碱槽Ⅲ中反应的化学方程式为__。
(5)离心机分离后的母液需要返回到溶碱槽__循环使用(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(6)气流干燥器中发生的化学方程式为__。
(7)为了测定所得产品中Na2S2O5的百分含量,取m克样品加水溶解,用cmol·L-1的碘标准液滴定到终点消耗碘标准液VmL.该产品中Na2S2O5的百分含量为__(用字母表示)。
【答案】增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率 氧气 Na2SO3 SO2+Na2SO3+H2O=2NaHSO3(或者2SO2+Na2CO3+H2O=2NaHSO3+CO2) Ⅰ 2NaHSO3=Na2S2O5+H2O ![]() %
%
【解析】
该原理为:硫磺燃烧生成SO2,净化后在溶碱槽Ⅰ中与碳酸钠反应生成NaHSO3与二氧化碳,NaHSO3在溶碱槽Ⅱ中与碳酸钠再反应生成Na2SO3,Na2SO3在溶碱槽Ⅲ中与SO2反应生成NaHSO3,过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;故答案为:增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
(2)由转化关系可知,反应中需要的是空气,故要除去多余的氧气,故答案为:氧气;
(3)SO2足量生成NaHSO3,若SO2不足,则生成Na2SO3,故答案为:Na2SO3;
(4)Na2SO3在溶碱槽Ⅲ中与SO2反应生成NaHSO3,若在溶碱槽Ⅱ中碳酸钠过量,那么碳酸钠在溶碱槽Ⅲ中也与SO2反应,故答案为:SO2+Na2SO3+H2O=2NaHSO3;(或者2SO2+Na2CO3+H2O=2NaHSO3+CO2);
(5)过饱和NaHSO3溶液经结晶、离心分离,故离心机分离后的母液为NaHSO3溶液,可和溶碱槽Ⅰ中与碳酸钠反应生成NaHSO3一起被用,故答案为:Ⅰ;
(6)过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5,反应为:2NaHSO3=Na2S2O5+H2O,故答案为:2NaHSO3=Na2S2O5+H2O;
(7)设产品中Na2S2O5的百分含量为ω,则利用化合价升降配平可知:2I2+S2O52-+3H2O=4I-+2SO42-+6H+,则有数量关系Na2S2O5~2I2,则n(Na2S2O5)= cmolL-1×VL×10-3×![]() =
=![]() Vc×10-3mol,所以产品的纯度为
Vc×10-3mol,所以产品的纯度为 =
=![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】已知:I2+2S2O32-=S4O62-+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):____________________________________________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用_______________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________________
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为__,第二周期第一电离能比B高的元素有__种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__(标出配位键),其中心原子的VSEPR模型名称为__,写出[BH4]-的两种等电子体__。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为__(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有__。
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E、C的坐标分别为B(1,0,0)、E(0,1,0)、C(0,0,1),请写出D点的坐标:D:___。