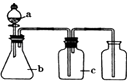
题目内容
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为;
(3)写出步骤③发生反应的离子方程式;
(4)步骤⑥的实验操作为、过滤、烘干.
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣被过量的氧化剂氧化所致.现给出以下试剂:1.0mol/L硫酸、1.0mol/LNaOH溶液、0.1mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合趣实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
【答案】
(1)坩埚
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+
(4)蒸发浓缩、冷却结晶
(5)取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明该同学的猜测是合理的,如不变红色,说明猜测不合理[或滴加过量的0.1mol?L﹣1Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理
【解析】解:(1)灼烧固体应该放在坩埚中,所以答案是:坩埚;(2)反应方程式:2Fe2++H2O2 +2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)铁单质能与三价铁离子和铜离子反应:2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+ , 所以答案是:2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+;(4)⑥为溶液得到晶体,则操作为蒸发浓缩、冷却结晶,所以答案是:蒸发浓缩、冷却结晶;(5)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,所以答案是:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明该同学的猜测是合理的,如不变红色,说明猜测不合理[或滴加过量的0.1 molL﹣1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理].

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D
【题目】近年来,硫化铜矿的湿法冶炼已经取得很大的进展.现有一种催化氧化酸浸硫化铜矿的湿法冶炼法,其工艺流程如1图所示: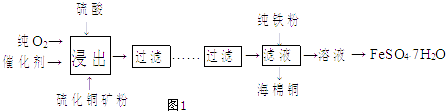
温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2﹣图5所示)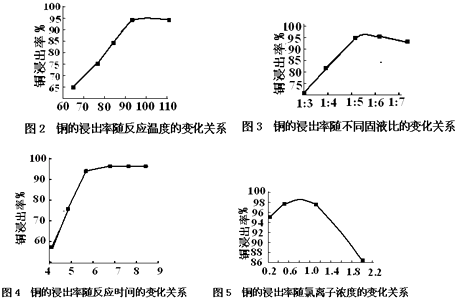
(1)根据实验以及工业生产的实际要求,从图2﹣图5中得出的最佳工艺条件为(从下表中选出序号) .
反应温度/℃ | 固液比 | c(Cl﹣)/molL﹣1 | 反应时间/h | |
A | 95 | 1:5.5 | 0.8 | 6 |
B | 100 | 1:5.5 | 0.7 | 7 |
C | 110 | 1:6 | 0.9 | 8 |
(2)上述流程从溶液中得到纯净的FeSO47H2O晶体的操作是蒸发浓缩、冷却结晶、过滤、、用乙醇淋洗、干燥.用乙醇淋洗的目的是: .
(3)副产品FeSO47H2O样品的纯度可用滴定法进行测定,实验步骤如下:步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中,
步骤3:用硫酸酸化的0.0100mol/L KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积
步骤4:重复步骤2、步骤3一至两次.
①步骤1中用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和 , 步骤2量取溶液所用仪器是 .
②写出步骤3反应的离子方程式:
③数据处理:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00mL | 0.02 | 40.01 |
2 | 25.00mL | 0.70 | 40.71 |
3 | 25.00mL | 0.20 | 39.20 |
计算上述样品中FeSO47H2O的质量分数为 .
④不考虑操作误差,用上述方法测定的样品中FeSO47H2O的质量分数(填偏低、偏高或无影响).